
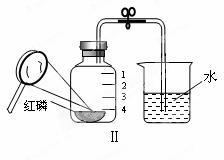
用来测定空气中氧气含量的方 法很多,图Ⅰ所示的是用红磷在空气中燃烧的测定方法。实验过程是:
法很多,图Ⅰ所示的是用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃a内的红磷,迅速伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被“吸入”集气瓶中,进入集气瓶中水的体积即为集气瓶中氧气所占的体积。
请完成下列问题:
(1)写出图中标号仪器的名称:a b  ;若实验成功,瓶中
;若实验成功,瓶中 水位将达
水位将达
刻度线(填数字)
(2)第二步中“迅速”是防止空气受 热膨胀而逸出,若缓慢操作,可能导致测得的结果 (“偏大”或“偏小”)
热膨胀而逸出,若缓慢操作,可能导致测得的结果 (“偏大”或“偏小”)
(3)集气瓶中剩余的气体主要是(填符号) ,从该实验可认识它的性质之一是:
。
(4)该实验的原理是用可燃物在空气中燃烧消耗氧气,使集气瓶中气压减小。有同学认为用
①硫粉 ②木炭 ③蜡烛 ④细铁丝四种物质代替红磷都可以。请从四种物质中选择一种,说明是否可以,并阐明理由: 。
(5)某同学对实验进行反思后,提出了改进方法(如图Ⅱ所示,凸透镜聚光点燃红磷),你认为改进后的优点是: 。

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
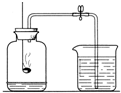
 28、“空气中氧气含量的测定”有多种方法.
28、“空气中氧气含量的测定”有多种方法.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 设计思路 | 预测的实验现象 |
| 第一: 用燃着的木条伸入集气瓶中 用燃着的木条伸入集气瓶中 |
木条火焰较快熄灭 木条火焰较快熄灭 |
| 第二: 往集气瓶中倒入少量澄清石灰水并振荡 往集气瓶中倒入少量澄清石灰水并振荡 |
澄清石灰水变浑浊 澄清石灰水变浑浊 |
 ,填画装置,设计测定体积分数实验装置图,并注明所用物质名称.
,填画装置,设计测定体积分数实验装置图,并注明所用物质名称.查看答案和解析>>
科目:初中化学 来源: 题型:
 如图,用红磷燃烧来测定空气中氧气含量.
如图,用红磷燃烧来测定空气中氧气含量.| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 点燃 |
| 点燃 |
| 1 |
| 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
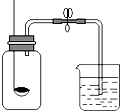 小华同学设计了如图所示的实验装置来测定空气中氧气的含量.实验步骤是:①先用弹簧夹橡皮管;②点燃燃烧匙内的红磷;③将燃烧的红磷迅速插入瓶内,并把塞子塞紧;④燃烧完毕,冷却后打开弹簧夹.
小华同学设计了如图所示的实验装置来测定空气中氧气的含量.实验步骤是:①先用弹簧夹橡皮管;②点燃燃烧匙内的红磷;③将燃烧的红磷迅速插入瓶内,并把塞子塞紧;④燃烧完毕,冷却后打开弹簧夹.| 点燃 |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com