
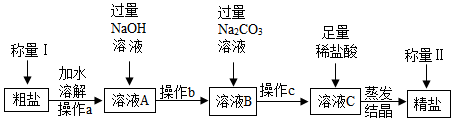
| 实验操作 | 实验现象 | 实验结论 | |
| 方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有气泡产生 | 猜想(2)成立 |
| 方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现溶液由无色变成红色. |
分析 Ⅰ.方案l:根据酸碱指示剂在不同酸碱性溶液中的变色情况来分析;
方案2:根据碱中加入酸发生中和反应后,溶液的pH变小,等于7或小于7来分析;根据化学反应的原理来书写化学方程式;
Ⅱ.【提出猜想】溶液变为了无色,说明不含有氢氧化钠,结合反应过程进行猜想;
【设计实验】根据酸和碱的性质以及酚酞试液的变色情况来分析;
【实验反思】根据酸的化学性质、检验方法来分析.
解答 解:Ⅰ.方案l:氢氧化钠溶液显碱性,滴入无色酚酞试液变红色,继续加入稀硫酸,硫酸与氢氧化钠发生中和反应生成硫酸钠和水,当加入的硫酸将氢氧化钠完全中和后,溶液变成无色;故填:红;
方案2:溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液(但是无论怎么加水稀释,溶液的pH也是大于7),所以向NaOH溶液中加入稀硫酸后,测得溶液的pH必须小于或等于7时才能证明酸和碱能发生反应.故填:小于或等于;
硫酸与氢氧化钠反应生成硫酸钠和水;故填:2NaOH+H2SO4=Na2SO4+2H2O;
Ⅱ.【提出猜想】氢氧化钠与硫酸反应生成硫酸钠和水,所以溶液中一定存在硫酸钠;若氢氧化钠有剩余,则还含有氢氧化钠(但是溶液是无色,说明一定不含氢氧化钠);若硫酸有剩余,则还含有硫酸,则溶液中的溶质是硫酸钠和硫酸;故填:H2SO4;
【设计实验】方案1:若猜想(2)成立,即反应后的溶液中存在硫酸钠和硫酸,加入锌粒后,锌与硫酸反应生成硫酸锌和氢气,会观察到有气泡产生;故填:气泡;
方案2:若猜想(2)成立,即反应后的溶液中存在硫酸钠和硫酸,向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管,氢氧化钠将其中的硫酸中和,继续滴加氢氧化钠,溶液显碱性,无色的酚酞试液变红色;故填:溶液由无色变成红色;
【实验反思】若证明有硫酸的存在,加入BaCl2溶液不可行,因为硫酸钠也能与氯化钡溶液反应生成白色的硫酸钡沉淀;铜与硫酸不反应,也不可行;氧化铁能够与硫酸反应生成硫酸铁和水,会观察到红色粉末消失,溶液有无色变成黄色;故填:C.
点评 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.


科目:初中化学 来源: 题型:解答题
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,则如图所示的化学反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
”表示氧原子,则如图所示的化学反应方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.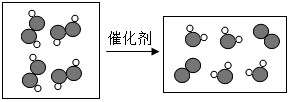
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
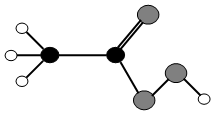 过氧乙酸是一种高效消毒剂,常用于环境消毒.其结构如图所示(“
过氧乙酸是一种高效消毒剂,常用于环境消毒.其结构如图所示(“ ”表示氢原子,“
”表示氢原子,“ ”表示碳原子,“
”表示碳原子,“ ”表示氧原子)请回答:
”表示氧原子)请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 4:5 | D. | 7:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
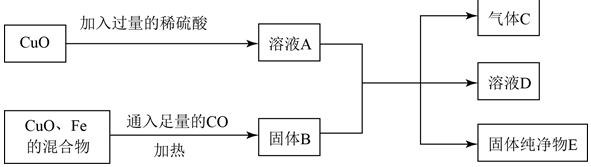
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com