
| 选项 | 方法 | 示例 |
| A | 实验法 | 用硫做“测定空气中氧气含量”的实验 |
| B | 归纳法 | 根据NaOH溶液、Ca(OH)2溶液等物质的化学性质,归纳出碱的通性 |
| C | 类比法 | 根据金属铁能与稀盐酸反应,推测金属铜也能与稀盐酸反应 |
| D | 分类法 | 根据组成物质的元素种类,将纯净物分为单质与化合物 |
分析 A.根据测定空气中氧气含量的方法来分析;
B.根据碱的通性来分析解答;
C.根据金属的活动性顺序来分析;
D.根据纯净物的分类来分析.
解答 解:A.硫在空气中燃烧生成二氧化硫气体,集气瓶内压强几乎不变,所以不能用硫来测定空气中氧气的含量,故错误;
B.因为NaOH和Ca(OH)2在溶液中电离出来的阴离子全部是氢氧根离子,故二者具有相似的化学性质--碱的通性,故正确;
C.在金属活动顺序中,铁排在氢的前面,能与稀盐酸反应生成氢气,而铜排在氢的后面,不能与稀盐酸反应产生氢气,故错误;
D.根据组成纯净物的元素的种类,有同一种元素组成的纯净物,属于单质,由两种或两种以上的元素组成的纯净物,属于化合物.
故答案为:B;单质与化合物.
点评 本题考查了研究和学习化学的基本方法,明确基本化学知识是解题的关键.


科目:初中化学 来源:安徽省巢湖市心学校2017届九年级中考强化训练化学试卷 题型:选择填充题
对下列实验中出现的异常现象分析合理的是( )
A. 制取CO2气体时,始终收集不到CO2一一收集CO2的集气瓶没盖严
B. 点燃氢气时,发生爆炸一一点燃前可能没有检验氢气的纯度
C. 细铁丝在氧气中燃烧时,集气瓶底炸裂一一收集的氧气不纯
D. 验证空气中氧气含量时.进入集气瓶中的水大于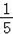 一一红磷过量
一一红磷过量
查看答案和解析>>
科目:初中化学 来源:2017届山东省日照市莒县九年级下学期第二次学业水平模拟测试化学试卷(解析版) 题型:信息分析题
在一次用餐中,同学们对“固体酒精”产生了好奇,于是对其成分进行研究。
【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。
【提出问题】(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
【实验探究】(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论_____(选填“合理”或“不合理”)。
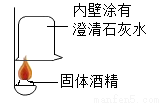
(2)为确定氢氧化钠的变质程度,分组探究。取少量固体酒精于烧杯中,加足量的水充分溶解后静置。
①甲组按下表探究:
实验步骤 | 实验现象 | 结论 |
取上层清液于试管中,滴加酚酞溶液 | 溶液变红 | 清液中有氢氧化钠 |
取上层清液于另一试管中,加入适量氯化钡溶液 | _____ | 清液中有碳酸钠 |
②乙组认为甲组实验不能证明清夜中一定有氢氧化钠,理由是______________。他们另取烧杯中上层清夜,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红。
【实验结论】经讨论一致认为固体酒精中的氢氧化钠部分变质。
【拓展应用】要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的___(填序号)
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 质量分数/% | 10℃ | 20℃ | 30℃ |
| 20% | 1.145 | 1.139 | 1.133 |
| 98% | 1.846 | 1.836 | 1.826 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 ”为铜片).
”为铜片).
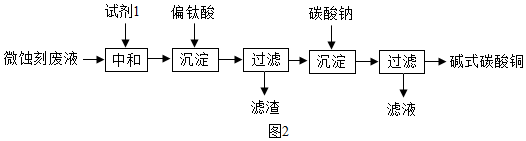
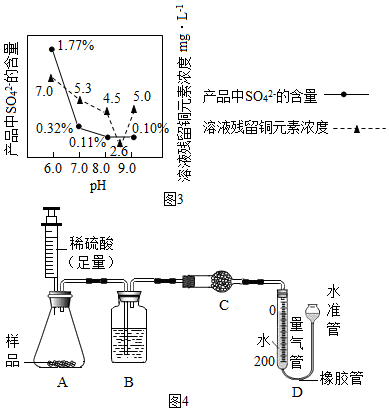
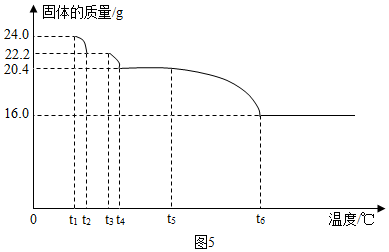
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝被广泛的应用于生产生活中,是因为铝的化学性质稳定 | |
| B. | 使用煤炉要防止中暑,是因为煤不充分燃烧产生的一氧化碳有毒 | |
| C. | 近视镜矫正近视是利用凹透镜对光有会聚作用 | |
| D. | 运动鞋鞋底有花纹是因为增大受力面积从而增大摩擦力 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 当水沸腾时,烧杯内气泡上升过程中受到水的压强变大 | |
| B. | 烧杯口有大量的“白气”冒出,这些“白气”是水蒸气遇冷后液化成的小水滴 | |
| C. | 水的沸点为98℃,此时烧杯内水面上方的气压小于1标准大气压 | |
| D. | 水在加热过程中,吸收热量,温度升高;沸腾时,吸收热量,温度不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com