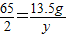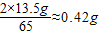实验室可用锌与稀硫酸反应制取氢气:Zn+H2SO4═ZnSO4+H2↑.现在实验室需要氢气2.24L(标准状况下,氢气的密度为0.089g/L).
(1)求参加反应的锌的质量.
(2)某兴趣小组用的是从废旧电池中得到的含杂质10%的锌皮制取氢气.现有这种废锌皮15g,与足量的稀硫酸反应,最多得到氢气多少克?
【答案】
分析:(1)依据氢气的体积结合锌和稀硫酸反应的方程式计算出反应的锌的质量即可;
(2)根据锌的纯度计算出锌的质量,而后利用方程式计算即可;
解答:解:(1)2.24 L氢气的质量为:2.24 L×0.089 g/L≈0.2 g
设参加反应的锌的质量为x
Zn+H
2SO
4═ZnSO
4+H
2↑
65 2
x 0.2 g
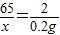
x=
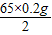
=6.5 g
(2)废锌皮中含锌的质量为:15 g×(1-10%)=13.5 g
设生成氢气的质量为y
Zn+H
2SO
4═ZnSO
4+H
2↑
65 2
13.5 g y
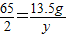
y=
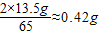
答:(1)参加反应的锌的质量是6.5g.(2)最多得到氢气0.42 g;
点评:此题是根据化学方程式的计算题,该题比较简单,就是用一种生成物的质量求一种反应物的质量,属于最基本类型的计算题.

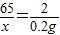
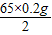 =6.5 g
=6.5 g