
| ||
| 加压 |
| A.为CO2的利用创造了一种新途径 |
| B.钌-磷铬合物的质量在反应前后发生了变化 |
| C.氢原子数在反应前后发生了改变 |
| D.属于置换反应 |
科目:初中化学 来源:2013-2014北京市朝阳区2014年中考一模化学试卷(解析版) 题型:填空题
(5分)同学们利用如下装置验证CO2能与NaOH反应。(装置气密性良好)

(1)打开K1、K3,关闭K2,当D中出现__________的现象时,可确定C中收集满CO2
(2)C中收集满CO2后,关闭K1,打开K2,将注射器中5mL浓NaOH溶液推入C中,观察到D中液体流入C中,说明CO2与NaOH发生了反应.
①小明发现此装置有明显不足,认为应该在 (填装置字母序号)之间增加洗气瓶E,其作用是 。
②改进装置后,小红认为要想证明CO2与NaOH发生反应,还应利用上述装置补充一个对比实验,实验方案是 。
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.K2SO4、NaOH、NaCl | B.CuSO4、MgCl2、NaCl |
| C.NaOH、HCl、K2SO4 | D.Na2CO3、K2SO4、HCl |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| H2SO4 |
| Zn |
| H2SO4 |
| CuO |
| A.消耗等质量的Zn、H2SO4、CuO |
| B.消耗的只有CuO质量相同 |
| C.过程中产生的ZnSO4质量相同 |
| D.所有反应类型都相同 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.水汽化形成的 | B.水蒸气液化形成的 |
| C.铁汽化形成的 | D.铁和水反应生成的 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
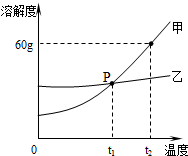
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com