
科目:初中化学 来源: 题型:阅读理解
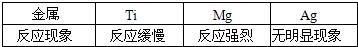
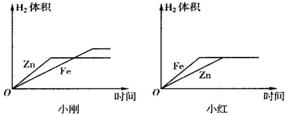
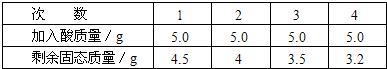
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验编号 | 温度 | 铝的规格 | 盐酸浓度 |
| ① | 20℃ | 铝片 | 5% |
| ② | 20℃ | 铝片 | 10% |
| ③ | 铝粉 | 10% | |
| ④ | 30℃ | 铝片 | 5% |
查看答案和解析>>
科目:初中化学 来源: 题型:
通过近一年的化学实验探究,小林发现金属和酸反应生成氢气的速率与金属的状态、酸的浓度、反应的温度等条件有关。下表是他对铝与稀盐酸反应受哪些条件的影响的探究(其中铝和稀盐酸每次的用量都相同)。请你根据表中的信息填空:
| 实验编号 | 温度 | 铝的规格 | 盐酸浓度 |
| ① | 20℃ | 铝片 | 5% |
| ② | 20℃ | 铝片 | 10% |
| ③ | 铝粉 | 10% | |
| ④ | 30℃ | 铝片 | 5% |
(1)写出铝与稀盐酸反应的化学方程式 ;
(2)用②和③来探究铝的状态对反应速率的影响,小林进行实验③时的温度为 ;
(3)要探究温度对反应速率的影响,小林设计的实验组合是 (填写实验编号);
(4)小林设计实验组合①②的目的是 ;
(5)实验探究时,小林每次收集的氢气均为30mL,则实验中他还应记录的实验数据是
;
(6)在进行上述铝与稀盐酸反应时,粗心的小林不小心将氢氧化钠溶液倒入了铝片中,发现也有气泡产生,好奇的他继续进行了如下实验探究:
【提出问题】铝与氢氧化钠溶液反应时生成的气体是什么?
【进行猜想】猜想①:可能是CO2;猜想②:可能是O2;猜想③:可能是H2。
你认为猜想 是不合理的,理由是 ;
【实验方案】①收集气体:实验时气体收集的方法是 ;
②检验气体:验证猜想②的方法是 ;
【得出结论】铝与氢氧化钠溶液反应的方程式为:
2Al+2NaOH+2H2O=2 +3H2↑(在横线上填上化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
回答下列问题,写出有关化学方程式。
(1)在硫酸铜溶液中加入氯化钡溶液,观察到的现象是 ,反
应的化学方程式为 。
(2)镁在空气中燃烧生成氧化镁和氮化镁(其中氮为-3 价),氮化镁与水反应生成氢氧
化镁和氨气(NH3)。
①写出氮化镁的化学式 。
②已知氮化镁是一种黄绿色的固体。根据镁在空气中燃烧的实验现象,可知在这样
的条件下,镁更易与空气中的 化合,理由是 。
③写出氮化镁与水反应的化学方程式 。
④ g 氮化镁中含有 24g 镁元素(精确到 0.1g)。
查看答案和解析>>
科目:初中化学 来源:2012年江苏省南通市如东县中考冲刺化学试卷(解析版) 题型:填空题
| 实验编号 | 温度 | 铝的规格 | 盐酸浓度 |
| ① | 20℃ | 铝片 | 5% |
| ② | 20℃ | 铝片 | 10% |
| ③ | 铝粉 | 10% | |
| ④ | 30℃ | 铝片 | 5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com