
分析 (1)C为氯化钠,D为氧化物,且在A溶液中加入铁粉能产生氢气,说明A为酸,结合稀盐酸能与氢氧化钠溶液反应生成氯化钠和水,进行分析解答.
(2)若A为稀盐酸,C、D为盐和水,可观察到溶液由无色变为黄色,且该反应不属于中和反应,黄色溶液中含有铁离子,结合氧化铁能与稀盐酸反应生成氯化铁和水,进行分析解答.
(3)若A为烧碱溶液,B是蓝色溶液,结合蓝色溶液中含有铜离子,氢氧化钠与含铜离子的溶液反应生成氢氧化铜蓝色沉淀,进行分析解答.
解答 解:(1)C为氯化钠,D为氧化物,且在A溶液中加入铁粉能产生氢气,说明A为酸,稀盐酸能与氢氧化钠溶液反应生成氯化钠和水,则A为稀盐酸,反应的化学方程式为:HCl+NaOH═NaCl+H2O.
(2)若A为稀盐酸,C、D为盐和水,可观察到溶液由无色变为黄色,且该反应不属于中和反应,黄色溶液中含有铁离子,氧化铁能与稀盐酸反应生成氯化铁和水,不属于中和反应,符合要求,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.
(3)若A为烧碱溶液,B是蓝色溶液,蓝色溶液中含有铜离子,氢氧化钠与含铜离子的溶液反应生成氢氧化铜蓝色沉淀,氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀和氯化钠,则观察到的现象是产生蓝色沉淀;然后滴入稀盐酸,氢氧化铜沉淀与稀盐酸反应生成氯化铜和水,又看到蓝色沉淀逐渐溶解.
故答案为:(1)稀盐酸;HCl+NaOH═NaCl+H2O;(2)Fe2O3+6HCl═2FeCl3+3H2O;(3)产生蓝色沉淀;蓝色沉淀逐渐溶解.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
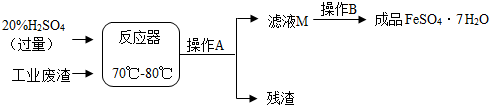
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
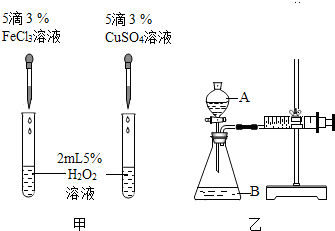
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
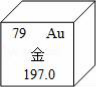 如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是A.
如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是A.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
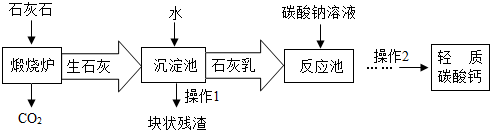
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com