
物质的溶解过程是:微粒向溶液中不断扩散的同时,溶液中的微粒也始终不断的向晶体聚集,只是不同时期的两种速率不同,当饱和时速率相等。氯化钠从溶液中析出是按具有规则的正八面体几何图形晶体析出。下列有关说法不正确的是( )
A.将氯化钠投入到20℃的氯化钠溶液中,晶体质量未变,该溶液是20℃的饱和溶液。
B.将不规则的氯化钠晶体,投入到氯化钠饱和溶液中,晶体图形变规则了。
C.向20℃的氯化钠饱和溶液中投入氯化钠晶体,氯化钠晶体的扩散不再进行。
D.氯化钠的溶液是![]() 、
、![]() 和水分子(暂认为水分子不电离)的混合物。
和水分子(暂认为水分子不电离)的混合物。
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:初中化学 来源: 题型:阅读理解
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
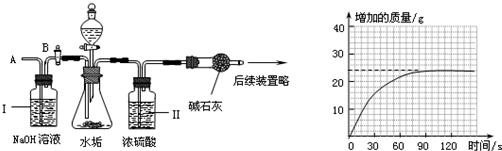
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 部分钙、镁化合物溶解性表(20℃) | |||
| 阴离子阳离子 | OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入 Na2CO3溶液. | 没有白色沉淀产生 | 一定含有CaCO3 一定不含Ca(OH)2 一定含有CaCO3 一定不含Ca(OH)2 |
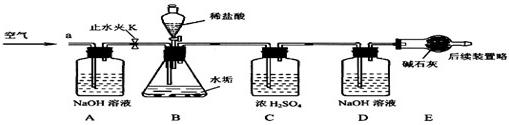
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| O | - 3 |
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 阴离子 阳离子 |
OH- | CO32- | HCO3- |
| Ca2+ | 微溶 | 不溶 | 可溶 |
| Mg2+ | 不溶 | 微溶 | 可溶 |
| 实验步骤 | 实验现象 | 结论 |
| 在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液. | 没有白色沉淀产生 | 水垢中 不含Ca(OH)2 不含Ca(OH)2 . |
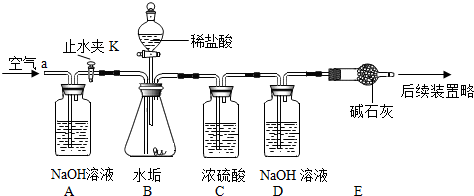
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | BaCO3 |
| 溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 不溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com