
����Ŀ����ѧ������������ϢϢ��ء��۲죬��ѧ�����������ߡ�������ѧ֪ʶ��գ�
��1��������˵�ġ��ӵ�ʳ�Ρ���������ʳ���в���һ�����ĵ���أ�KIO3�����Բ�����������ĵ�Ԫ�ء���Ԫ�������彡��������������_____�����������������Ԫ�ء�����ȱ����������ᵼ��____________________��
��2������أ�KIO3���е�Ԫ�أ�I���Ļ��ϼ���__________�����������������ƣ����ȵ���ػ�ֽ⣬���ɵ⻯�غ�������д���÷�Ӧ�Ļ�ѧ����ʽ___________________________���ڼ��ȹ����У����ɵĵ⻯�ػ�����δ�ֽ�ĵ���ط�Ӧ��5KI + KIO3 ![]() 3X + 3I2 ������X�Ļ�ѧʽ��________����ˣ����ʱ���˹������ӵ��Ρ�
3X + 3I2 ������X�Ļ�ѧʽ��________����ˣ����ʱ���˹������ӵ��Ρ�
��3���ճ������ţ�̰�װ�С����ϴ�������_____������ţ���
���������� ���л��ϳɸ߷��Ӳ��� �����ϲ���
��4����ͭ��ͭ��п�ĺϽ���Ӳ��______������ڡ���С�ڡ�����ͭ����������пƬ��������ͭ��Һ�У��۲쵽_________________________������˵��п��ͭ���á�
���𰸡��� ��״���״� +5 2KIO3![]() 2KI+3O2�� K2O �� ���� п���渽��һ���ɫ���ʣ���Һ����ɫ�����ɫ
2KI+3O2�� K2O �� ���� п���渽��һ���ɫ���ʣ���Һ����ɫ�����ɫ
��������
��1������������������Ԫ�أ����Ǻϳɼ�״�ټ��ص���ҪԪ�أ�ȱ���͵�������Ỽ��״���״�
��2����KIO3�У����ڼ�Ԫ����+1�ۣ���Ԫ����-2�ۣ���I�Ļ��ϼ�Ϊx ����+1+x+��-2����3=0����˵�Ԫ����+5�ۣ���������ȷֽ����ɵ⻯�غ��������÷�Ӧ�Ļ�ѧ����ʽ��2KIO3![]() 2KI+3O2�������ݻ�ѧ����ʽ��5KI + KIO3
2KI+3O2�������ݻ�ѧ����ʽ��5KI + KIO3![]() 3X + 3I2����ѧ��Ӧǰ��ԭ�����ࡢ��Ŀ���䣬����֪X�Ļ�ѧʽΪK2O��
3X + 3I2����ѧ��Ӧǰ��ԭ�����ࡢ��Ŀ���䣬����֪X�Ļ�ѧʽΪK2O��
��3��ţ�̰�װ�С����ϴ����ڵ��͵ĸ߷��Ӳ��ϣ�
��4����ͭ��ͭ��п�ĺϽ���Ӳ�ȴ��ڴ�ͭ���ڽ����Ļ��˳���У�����ǰ��Ľ����ܰѺ���Ľ�������������Һ���û�������п�Ļ�Ա�ͭ�Ļ��ǿ����˹۲쵽������Ϊп���渽��һ���ɫ���ʣ���Һ����ɫ�����ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ��ʯ����Ҫ�ɷ� CaCO3��������ʯ�ң�CaO���Ͷ�����̼��Ϊ�˲ⶨijʯ��ʯ��̼��ƣ�CaCO3���ĺ������ֳ�ȡ 24.0g ʯ��ʯ��Ʒ�������Ĵθ������ա���ȴ������ʣ���������� �����ʲ��μӷ�Ӧ������¼ʵ���������£�
���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
ʣ��������� | 21.6g | 19.2g | 15.2g | 15.2g |
�Լ��㣺
��1����ȫ��Ӧ�����ɶ�����̼������Ϊ_____��
��2�����ʯ��ʯ��Ʒ��̼��Ƶ�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȷ�Ļ�ѧ������գ�
��1����Ԫ��_____����2��3����ԭ��________����3���ĸ�����������_________��
��4��������������________________����5�����������___________��
��6���������и�Ԫ�صĻ��ϼ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����һ������20t��ʯ�Ĺҳ������㽭���������ϴ���ų�·��ȼ�����ܴ�����¹�·���ϣ���·��������������ȼ�ŵ�ʯͷ������������������������һ�죬�����ٱ��Դ��Ҳ�����ߣ�����������
����������ѧ�ţ�1���ѧ��ȤС���������������Ũ����Ȥ��Ϊ�˽���̽��������һ����롣
���������ϣ���ʯ[CaC2]��һ����Ҫ�Ļ���ԭ�ϣ���ˮ���������ҷ�Ӧ���ų��������ȣ�����һ�ֿ�ȼ����[C2H2]��һ�ְ�ɫ���塣
��������⣩��ɫ������ʲô���ʣ�
�����в��룩С�������ɫ���������CaO��Ca(OH)2��Ca(HCO3)2��CaCO3�е�һ�֡�
��1������ΪС�������������_____��
��2��С���������ĺ��֪����ɫ���岻��Ca(HCO3)2��ͬʱ��������е�CaOҲ�����ڣ�����Ϊ��ɫ���岻��CaO�������ǣ��û�ѧ����ʽ��ʾ��_____��
��ʵ��̽����С�ƶ�ɫ���彲��̽���������æ��ɡ�
ʵ�鷽�� | ʵ����� | ʵ������ | ʵ����� |
С�Ƶķ��� | ȡ������ɫ�������Թ��У������м���ϡ���� | �����ܽ⣬������ð�� | _____ |
�ҵķ��� | _____ | _____ | ��ɫ������Ca(OH)2 |
���ۺ�Ӧ�ã���������������������ȼ�ױ��������������ʱӦע���������һ���������飺 _____��
����չ���£����������ڿ������ױ��ʣ������ʺ�Ĺ�����ֻ����̼��ƺ��������ƣ�ȡ���ʺ�Ĺ���17.4g���뵽150gϡ������ǡ����ȫ��Ӧ�����ɶ�����̼������Ϊ4.4g������ʺ�Ĺ�����̼��Ƶ���������Ϊ_____����Ӧ��������Һ�����ʵ���������Ϊ_____��ֻд����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ϢϢ��أ����û�ѧ֪ʶ�ش��������⣺
��1�����촵�ܰ�ȼ�ŵ����յ������������õ�ԭ����_____��
��2����������������һ����������ʱ��һ��С���Ǿ�����ʹ��ȼ�գ���˵�����͵��Ż���_____ ����ߡ��͡�����
��3����ī��д����Ƶ��ֻ��ܹ�����ܳ�ʱ�䲻��ɫ��ԭ����_____��
��4�����ι�Ϊ��ɫ��ĩ������þ��������跴Ӧ��ȡ���仯ѧ����ʽΪ��SiO2+2Mg![]() Si+2MgO���÷�Ӧ�л�ԭ����_____��
Si+2MgO���÷�Ӧ�л�ԭ����_____��
��5���������ִ������в���ȱ�ٵĽ�ͨ���ߣ��������IJ��ָ�����������������Է�ֹ�����⣬ԭ����_____��
��6����ʯ�ҽ���ˢǽ�ڣ������ǽ��ͱ�Ӳ�ˣ���������_____���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ƽ���HIN1���е���ЧҩƷ֮һ������Ҫ����ԭ���ǰ˽������е�ç���ᣨC7H10O5�������й���ç�����˵���У���ȷ���ǣ�������
A. ç����ĺ�̼��������ԼΪ48.28%
B. ç������7��̼ԭ�ӡ�10����ԭ�ӡ�5����ԭ�ӹ���
C. ç�������Է�������Ϊ174��
D. ç������̼��������Ԫ�ص�������Ϊ7��10��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ����ÿ�����������ʧ�ĸ���Լռ��������������1/4��ijͬѧ��̽��������������������ɾ��������ֱ�ͬʱ����A��B��C��֧�Թ��н���̽����
�����ʵ�飩���������ͬѧ�������ʵ����Ƶ����ݣ�
��� | �������� | ʵ��Ŀ�� |
A | �ڸ�����Թ��з��������������������� ����������� | ̽������_____����������� |
B | ����������ע������ˮ��û����������ֲ ����Һ�� | ̽������_____����������� |
C | _____ | ̽��������������ˮͬʱ����ʱ��������� |
��ʵ����ۣ�һ�ܺ��Ϊ_____���Թ��е������������⡣
����չ���죩ƻ���п����ã������Ͼͻ����һ�㿧��ɫ�����ʣ�Ҳ���������ˡ��⡱һ����
��1���п���ƻ�������⡱��ʲô�����йأ�
�����������������û�й�ϵ��ֻ�ǹ����ڵ������������Ӧ�������⡱��
�������������ǹ����е�����������е��������ö������⡱��
�������������ǹ����е�����������еĵ������ö������⡱��
�������������ǹ����е�����������еĶ�����̼���ö������⡱��
��2���������ϣ���֪ƻ�������⡱�ǹ���������ʣ��Ӻ�ø��������е�һ�����ʷ�����Ӧ�����ɿ���ɫ�����ʡ��Ҳ��п���ƻ��û�д���������ƻ�������⡱��������ء�
��3���������������У�����Ϊ����_____�������������_____��
��ʵ��Ӧ�ã���1������ͬ����������������ͬ������������ˣ���װ���غ��Ȱ�װ����½�������⣬����Ҫԭ����_____��
��2����ʱ������Ʒ��ʴ��һ������Ϊ��ʴ������ģ�������Ͱʢװũҩ������Һ��������ͭ��Һ���ͺ����ױ���ʴ��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬѧ���������������������װ��һ����������Ʒ��Ϊ��504˫�����������ǩ��ͼ1��ʾ�����Ϻͱ�����������õ���504˫������������Ʒ�ܺ��棬�������ʵ�����̽����
��������⣩���ù���ijɷ���ʲô��
���������ϣ������Ȼ�����Һ�ڳ����·�����Ӧ�����Ȼ�������
���������룩���ù����п��ܺ���Fe��Fe2O3��CaO��Ca��OH��2��CaCO3��
��ʵ��̽����
����ͬѧ�ķ�����
ʵ����� | ʵ������ | ʵ����� |
ȡ������������Թ��У��μ�������_____�� | ��������ʧ������ɫ����������õ�dz��ɫ��Һ�� | ������һ������_____�� һ������Fe2O3�� |
����ͬѧ��Ϊ����ͬѧ��ʵ�鲢���ܵó�һ������Fe2O3�Ľ��ۣ�������_____���������ͼ2ʵ�鷽��������֤��
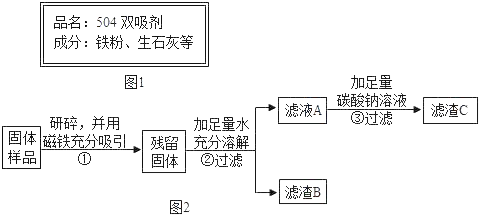
��1���������Ʒ�ô�������ǰ�辭�����飬���������Ŀ����_____��
��2��������й����ܽ�ʱ�ų������ȣ��ɴ˿����жϹ�����һ������_____��д���ù����еĻ�ѧ����ʽ_____��
��3��������з�Ӧ�Ļ�ѧ����ʽ��_____��
����ͬѧ������B�ֽ���̽����
ʵ����� | ʵ������ | ʵ����� |
��ȡ����B���Թ��У��������� _____ �����ɵ�����ͨ��_____ | �ٹ�����٣�_____ �ڸ���Һ����ǣ� | ������һ������CaCO3 ��Fe2O3�� |
��ʵ����ۣ��ۺ�����ʵ�鼰�������ݣ��þ��ù�����һ�����е�������Fe��Fe2O3��CaO��CaCO3��
��ʵ����չ��Ϊ��ǿ˫����������Ч��������˫�����м���һ������NaCl��NaCl�����ÿ�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ�������ʵ�ʯ��ʯ����Ҫ�ɷ�ΪCaCO3����Ʒ6g����ʢ��46.2 gϡ������ձ��У�����ǡ����ȫ��Ӧ���Ƶ÷�Ӧ���������ʵ�������Ϊ50g��(��֪���ʲ���ϡ���ᷴӦ)���㣺
��1����Ӧ�����ɵĶ�����̼���������Ϊ_________g��
��2��ԭ��Ʒ��CaCO3�����Ƕ���________��
��3��ԭ��Ʒ��CaCO3���������Ƕ���________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com