
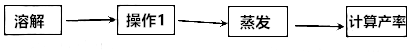
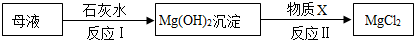
分析 (1)实验室中除去泥沙等杂质时,实验步骤是溶解、过滤蒸发,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热;
(2)A.粗盐未充分溶解就过滤,会导致蒸发后精盐质量偏小;
B.蒸发时未用玻璃棒搅拌,会导致部分氯化钠损失,从而导致蒸发后精盐质量偏小;
C.蒸发后,所得的精盐较潮湿,会导致蒸发后精盐质量偏大;
D.称量精盐时,精盐与砝码放反了,会导致称量结果偏大;
(3)氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,稀盐酸和氢氧化镁反应生成氯化镁和水;
(4)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类和总个数都不变.
解答 解:(1)操作1的名称是过滤,该操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗;
在加热蒸发过程中,当蒸发皿中出现较多固体时,停止加热.
故填:过滤;漏斗;出现较多固体.
(2)A.粗盐未充分溶解就过滤,会导致蒸发后精盐质量偏小;
B.蒸发时未用玻璃棒搅拌,会导致部分氯化钠损失,从而导致蒸发后精盐质量偏小;
C.蒸发后,所得的精盐较潮湿,会导致蒸发后精盐质量偏大;
D.称量精盐时,精盐与砝码放反了,会导致称量结果偏大.
故填:CD.
(3)氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,稀盐酸和氢氧化镁反应生成氯化镁和水,因此物质X是盐酸.
故填:盐酸.
(4)因为反应物中金属元素只有钠元素,因此电解饱和NaCl溶液生成的碱是氢氧化钠,猜想的依据是质量守恒定律.
故填:NaOH;质量守恒定律.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
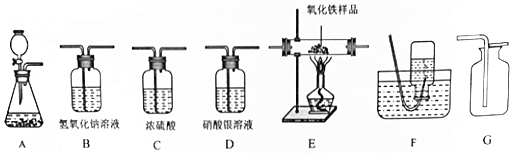
| 装置编号 | D | C1 | C2 | B |
| 试剂 | 硝酸银溶液 | 浓硫酸 | 浓硫酸 | 氢氧化钠溶液 |
| 现象或质量变化 | 无明显现象 | 增重1.0g | 增重2.7g | 增重0.66g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、HCO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | H+、Na+、OH-、SO42- | D. | Ag+、Ca2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com