
【题目】化学课外小组同学取8g石灰石(主要成分是CaC03)样品于烧杯中,进行测定实验。现将40g稀盐酸 分四次加入烧杯中(反应的化学方程式为:CaC03+2HCl=CaCl2+C02↑+H20,石灰石中其他杂质不溶于水也不参与反应,反应生成的CaCl2能全部溶解在水中),充分反应后,测得有关数据如下表所示:
实验 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸的质量/g | 10 | 10 | 10 | 10 |
烧杯中剩余固体的质量/g | 5.5 | 3.0 | m | 1.2 |
(1)8g石灰石样品中杂质的质量为__________g;
(2)上表中m的数值是____________;
(3)高温锻烧石灰石样品可制得生石灰(CaO)和二氧化碳。如果锻烧这种石灰石样品100kg(杂质不反应),理论上最多能制得氧化钙多少____________kg?(根据化学方程式列式计算,注意格式的规范)
【答案】1.2 1.2 47.6g(详见解析)
【解析】
第一次加入10g盐酸,固体减少2.5g,可以猜测每10g盐酸能消耗碳酸钙2.5g,则第二次加入后固体剩余3g,又消耗碳酸钙2.5g,若固体碳酸钙足量,第三次应剩余0.5g,第四次加入还剩余1.2g说明第三次已将石灰石中碳酸钙完全消耗,也就确定m就应该为1.2g。最后1.2g应该为不能反应的杂质。
根据以上分析可知:
(1)8g石灰石样品中杂质的质量为1.2g;
(2)上表中 m 的数值是1.2g;
(3)碳酸钙的总质量为8g-1.2g=6.8g,样品中碳酸钙的质量分数=![]() ,100kg中碳酸钙的质量=100kg×85%=85kg。
,100kg中碳酸钙的质量=100kg×85%=85kg。
设:85kg 的碳酸钙分解生成氧化钙的质量为x。

![]() x=47.6kg
x=47.6kg
答:如果锻烧这种石灰石样品 100kg(杂质不反应),理论上最多能制得氧化钙47.6kg。


科目:初中化学 来源: 题型:
【题目】“宏观-微观-符号”是化学独特的表示物质及其变化的方法。
(已知:2Na+Cl2![]() 2NaCl)。请回答下列有关问题:
2NaCl)。请回答下列有关问题:
(1)上述反应说明燃烧__(填“一定”或“不一定”)需要氧气;从物质的分类角度看,氯化钠属于__;氯化钠中钠元素、氯元素的质量比为__。
(2)上述变化过程中,同种原子的个数反应前后__(填“有”或“没有”)增减;该反应中钠元素的化合价由__价变为__价。
(3)用化学符号或名称表示:
① 氯化钠中的阴离子为__。
② Cl2:__。
③“Na”可表示为钠单质、或钠元素、或钠__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是用比例模型来表示物质间发生化学反应的微观示意图。图中“![]() ”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是( )
”分别表示两种元素的原子,一定条件下发生的下列反应能用下图表示的是( )

A. N2 + O2 = 2NO
B. 2CO + O2 = 2CO2
C. 2H2 + O2 = 2H2O
D. N2 + 3H2 = 2NH3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某品牌矿泉水的标签中矿泉水主要成分如下表所示,请根据本表回答下列问题:
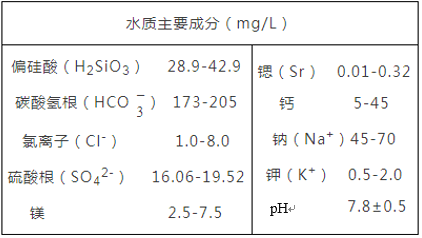
①氯化镁的化学式是_________ .
②三个钙离子的化学符号是_______。
③用结构示意图表示Cl-的核外电子排布_______。
④请在偏硅酸化学式中标记硅元素的化合价_______。
⑤矿泉水属于_______(填“纯净物”或“混合物”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】任何化学反应的各反应物和生成物之间都存在着一定的质量比。下列说法正确的是( )
A. 2 克氢气在 8 克氧气中充分燃烧,生成 10 克水 B. 1 克氢气在 8 克氧气中充分燃烧,生成 9 克水
C. 2 克氢气在 32 克氧气中充分燃烧,生成 34 克水 D. 1 克氢气在 16 克氧气中充分燃烧,生成 18 克水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再将100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | 35.2 | 58.4 | 82.6 | 107.6 |
(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该石灰石样品中碳酸钙的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某班同学验证质量守恒定律实验的片段。
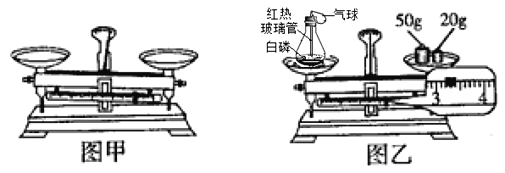
(1)如图甲所示,天平无法调节平衡。要使该天平平衡,应采取的措施________;
(2)小璐用图乙所示装置进行实验。反应前称得左盘内装置及物质总重量为_______g,然后引燃白磷,充分反应后并冷却至室温,能证明质量守恒定律的现象是_______;发生反应的化学方程式为_____;
(3)下列对该实验的评价,你认为合理的是____ (填序号)。
A、白磷用量的多少,会对证明质量守恒定律的结论产生影响
B、去掉气球,天平仍将保持平衡
C、未等冷却至室温就进行称量,天平可能会失去平衡
查看答案和解析>>
科目:初中化学 来源: 题型:
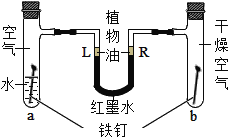
【题目】某同学设计了如图所示的装置探究铁锈蚀的条件.a管中装入少量煮沸的蒸馏水,b管中是干燥的空气.调节L端与R端的液面高度一致,塞紧木塞.一段时间后观察到_____管(填“a”或“b”)中的铁钉会锈蚀,L端比R端的液面高度_____(填“高”或“低”)。该实验说明铁的锈蚀与_______和_______有关。写出防止铁钉生锈的一种具体方法________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室模拟工业炼铁的装置图.
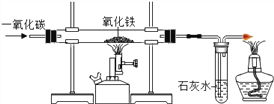
(1).分别写出硬质玻璃管内产生的现象____________________________
反应的化学方程式_________________
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是_________________________________。
(3)高炉炼铁中,焦炭的两个作用是_________________________(用化学方程式表示)。
(4)用含氧化铁80%的赤铁矿200t,可炼制含杂质2%的生铁_______吨
(5)某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的金属可能是___________
A.Zn 和Fe B.Cu和Ag C.Zn和Cu D.Mg 和Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com