30克不纯的铁与足量的稀盐酸反应,产生了1克氢气,则该铁样品中含的杂质可能是( )
A.Cu
B.Mg
C.Al
D.Na
【答案】
分析:根据铁与盐酸反应的化学方程式可以计算出产生1g氢气所需纯铁的质量,确定不纯的铁中所含的杂质具备的条件,根据金属完全反应产生氢气的质量=
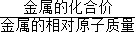
×金属的质量,判断可能含有的金属.
解答:解:设产生了1g氢气消耗的纯铁的质量为x.
Fe+2HCl=FeCl
2+H
2↑
56 2
x 1g
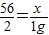
x=28g
28g<30g,说明不纯的铁中所含的杂质可能是不能与盐酸反应或等质量的铁和所含杂质相比,杂质与盐酸反应产生的氢气少.
金属完全反应产生氢气的质量=
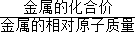
×金属的质量,故等质量的铁、镁、铝、钠产生氢气的质量质量由多到少的顺序是:铝>镁>钠>铁.
A、铜不与稀盐酸反应,故符合要求.
B、等质量的铁、镁产生氢气的质量为铁<镁,不符合要求.
C、等质量的铁、镁产生氢气的质量为铁<铝,不符合要求.
D、等质量的铁、镁产生氢气的质量为铁<钠,不符合要求.
故选A.
点评:本题有一定难度,考查了学生应用化学方程式计算判断金属的成分,本题解题关键是所含杂质:不能与盐酸反应或能产生氢气且与铁的质量相等时比铁产生的氢气少.

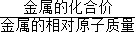 ×金属的质量,判断可能含有的金属.
×金属的质量,判断可能含有的金属.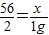 x=28g
x=28g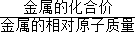 ×金属的质量,故等质量的铁、镁、铝、钠产生氢气的质量质量由多到少的顺序是:铝>镁>钠>铁.
×金属的质量,故等质量的铁、镁、铝、钠产生氢气的质量质量由多到少的顺序是:铝>镁>钠>铁.

 阶梯计算系列答案
阶梯计算系列答案