
| 甲 | 乙 | 丙 | |
| 所取食盐水的质量/g | 100 | 50 | 50 |
| 加入AgNO3溶液的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀物的质量/g | 1.435 | 1.435 | 1.435 |
分析 氯化钠与硝酸银反应生成氯化银和硝酸钠;分析实验数据表中所取海水样品质量与加入硝酸银溶液质量的关系,判断两种溶液恰好完全反应的实验;利用生成沉淀氯化银的质量根据反应的化学方程式,计算食盐水中氯化钠的质量,即可完成最终质量分数的计算.
解答 解:(1)氯化钠与硝酸银反应生成氯化银和硝酸钠,方程式为NaCl+AgNO3=AgCl↓+NaNO3;
(2)从数据分布规律看,生成1.435g沉淀物两种溶液各需50g,多余的溶液没有反应.
设参加反应的硝酸银质量为x
NaCl+AgNO3=AgCl↓+NaNO3
170 143.5
x 1.435g
$\frac{170}{x}$=$\frac{143.5}{1.435g}$
(3)丙同学实验后硝酸银溶液过量,溶液中溶质的组成有NaNO3、AgNO3;
(4)设恰好完全反应时生成硝酸铵的质量为y
NaCl+Ag NO3=AgCl↓+NaNO3
143.5 85
1.435g y
$\frac{143.5}{1.435g}$=$\frac{85}{y}$
y=0.85g
所得溶液中再加入1.435g水后所得溶液的溶质质量分数为$\frac{0.85g}{50g+50g-1.435g+1.435g}$×100%=0.85%
故答案为:(1)NaCl+Ag NO3=AgCl↓+NaNO3
(2)$\frac{170}{x}$=$\frac{143.5}{1.435g}$
(3)NaNO3、AgNO3;
(4)0.85%
点评 三次实验中海水样品质量与所加硝酸银溶液质量的变化是本题分析的关键,对比三次实验中两种溶液与生成沉淀的关系就能找出两溶液进行反应的质量关系.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
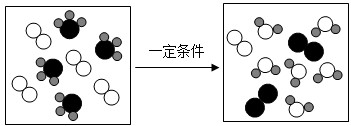
| A. | 反应物中包含两种化合物 | B. | 该反应有三种新物质生成 | ||
| C. | 该反应属于置换反应 | D. | 发生反应的分子个数比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10g | B. | 49g | C. | 159g | D. | 480g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
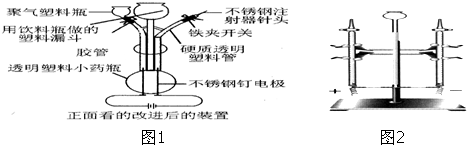
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
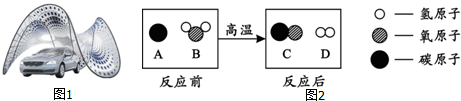
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 鱼类能在水中生存,证明氧气易溶于水 | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 收集满氧气的集气瓶正放在实验桌上,因为通常状况下氧气的密度比空气的密度大 | |
| D. | 工业上用分离液态空气的方法制取氧气,利用了氧气的沸点比氮气的沸点低 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间(S) | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量(g) | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
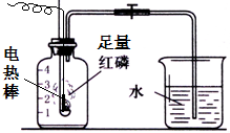 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com