
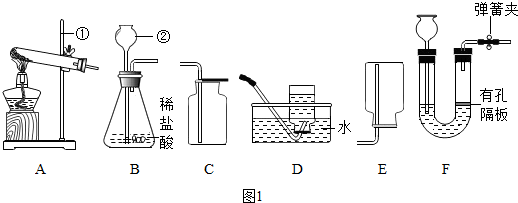
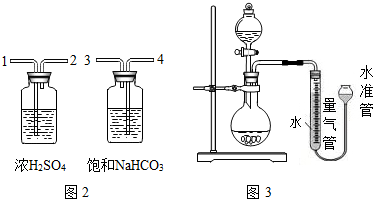
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)利用加热的方法制取气体,并且利用排水法收集气体时,要按照一定的步骤进行,特别是要注意集满气体后的操作顺序,以防发生安全事故;
(3)加热条件下,氯化铵和氢氧化钙反应生成氯化钙、水和氨气;
(4)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大;
不同的实验装置,优缺点不同;
碳酸氢钠能和稀盐酸反应生成氯化钠、水和二氧化碳,浓硫酸能够吸收二氧化碳中的水蒸气;
(5)实验过程中,如果操作不当,会影响实验结果,甚至会导致实验失败.
解答 解:(1)①是铁架台,②是长颈漏斗.
故填:铁架台;长颈漏斗.
(2)实验室选用A、D装置制取O2,气体收集完毕时,应先从水中取出导气管,后熄灭酒精灯.
故填:从水中取出导气管.
(3)实验室可用氯化铵固体和熟石灰混合加热制取NH3,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
故填:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
(4)①二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用C装置收集;
若将发生装置由B改为F,其优点是能使反应随时进行或停止,原理是:关闭开关时,U管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止;
打开开关时,气体导出,U管中的气体减少,压强减小,液体和固体混合,反应进行.
故填:C;能使反应随时进行或停止.
②为了得到纯净、干燥的CO2,除杂装置的导管按气流方向连接顺序是4→3→1→2.
故填:b.
③饱和NaHCO3溶液的作用是除去二氧化碳中的氯化氢气体,反应的化学方程式为:NaHCO3+HCl═NaCl+CO2↑+H2O.
故填:NaHCO3+HCl═NaCl+CO2↑+H2O.
(5)为了准确测定氧气的体积,容器中气体必须冷却至室温,应上下移动水准管,待两管液面相平再读数,视线应与液体凹液面最低处保持水平,因此必须要做到的是①③④.
故填:①③④.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 化学变化多姿多彩,美丽如花.如图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是Fe2O3其中一条化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
化学变化多姿多彩,美丽如花.如图中甲、乙、丙、X分别是Fe2O3、C、CO、盐酸中的某一种,甲、乙、丙均能与X发生化学反应,则X是Fe2O3其中一条化学方程式Fe2O3+6HCl═2FeCl3+3H2O.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
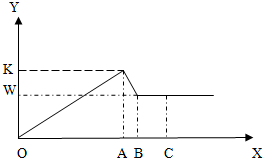 甲、乙、丙三位同学对氯化镁样品(仅含氯化铝杂质)进行如下检测:取457g样品溶于一定量的水中得到8000g溶液,再逐渐加入固体氢氧化钠,反应得到沉淀和加入的氢氧化钠的质量图象如图:(已知氢氧化铝沉淀可以和氢氧化钠溶液反应生成无色溶液,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O)
甲、乙、丙三位同学对氯化镁样品(仅含氯化铝杂质)进行如下检测:取457g样品溶于一定量的水中得到8000g溶液,再逐渐加入固体氢氧化钠,反应得到沉淀和加入的氢氧化钠的质量图象如图:(已知氢氧化铝沉淀可以和氢氧化钠溶液反应生成无色溶液,反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com