(2006?菏泽)学校化学兴趣小组为测定我市一铸造厂原料生铁中铁的质量分数,在实验室将8.7g生铁样品放入烧杯中,加入50g稀硫酸恰好完全反应(杂质不参加反应),反应后称得烧杯中剩余物质的总质量为58.4g,求:
(1)产生氢气的质量是多少?
(2)该生铁样品中铁的质量分数?(结果保留一位小数)
【答案】
分析:生铁为含碳2%~4.3%的铁合金,其中铁与硫酸反应生成硫酸亚铁和氢气;根据质量守恒定律,反应前后烧杯中物质总质量差即为放出氢气的质量,根据氢气的质量利用反应的化学方程式可计算出恰好完全反应时消耗铁的质量,即样品中铁的质量,据此可计算样品中铁的质量分数.
解答:解:(1)恰好完全反应后产生氢气的质量=8.7g+50g-58.4g=0.3g
(2)设恰好完全反应消耗铁的质量为x
Fe+H
2SO
4=FeSO
4+H
2↑
56 2
x 0.3g

x=8.4g
生铁样品中铁的质量分数=
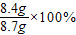
≈96.6%
答:(1)产生氢气的质量是0.3g;
(2)该生铁样品中铁的质量分数约为96.6%.
点评:在任何与周围隔绝的体系中,不论发生何种变化或过程,其总质量始终保持不变.反应中因氢气放出而使烧杯内物质总质量变小,这是解决本题的关键.


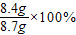 ≈96.6%
≈96.6%

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案