
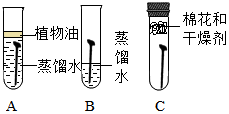
 小林同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图.经过一周观察:试管A 和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀.根据上述描述请你完成:
小林同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图.经过一周观察:试管A 和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀.根据上述描述请你完成:分析 (1)根据已有的知识进行分析,铁在与水和氧气并存时易生锈,铁锈的主要成分是氧化铁;
(2)煮沸后水中的氧气几乎没有了,干燥剂是吸收了试管内的水;
(3)金属制品的防护方法主要有三个:①保持金属制品表面的干燥与洁净;②涂一层保护膜;③改变其内部结构.
(4)根据铁生锈所需满足的条件,判断做法中不能破坏铁生锈条件的做法.
解答 解:(1)铁在与水和氧气并存时易生锈,铁锈的主要成分是氧化铁,故填:H2O,O2,Fe2O3;
(2)事先将蒸馏水加热可以除去水中溶解的氧气,加入干燥剂是为了除去试管中的水蒸气;故填:除去溶解在水中的氧气;除去空气中的水蒸气;
(3)自行车的链条常采用涂油的方法防锈,也是一层保护膜;自行车的车身(即车架)常采用喷漆防锈.故答案为:涂油;喷漆;
(4)为阻止铁器生锈可保持铁器干燥或在表面形成一层保护层以隔绝铁与氧气和水的接触,刷漆、涂油、镀一层耐腐蚀的金属都可有效地隔绝铁与氧气和水的接触,而水洗却使铁与水充分接触,不利用阻止铁器生锈;故填:③.
点评 本考点与生活实际联系比较多,乳化作用也是新课标中新加入的一个知识点,金属制品的防护在生活中也比较常见,基础性比较强,一定要加强记忆.对于防锈要根据物质的用途与价值来选择合适的防锈措施.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 剧烈燃烧 | B. | 火星四射 | C. | 放出大热的热 | D. | 生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属资源中金、银、铜、铁等在地壳中主要以单质的形式存在 | |
| B. | 炼铁时将铁矿石、焦炭等原料放入高炉,最后从出铁口得到纯铁 | |
| C. | 地壳中含量最多的金属元素是铁元素 | |
| D. | 金属资源有限,不能随意开采 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com