
分析 ( )根据活性炭具有吸附性解答;
(2)根据生活中常用肥皂水来区分硬水和软水解答;
(3)根据电解水的原理书写化学方程式即可;因为在化学变化中原子的种类及个数不会改变,所以反应后的氢氧原子数之比也是2:1,再结合氢分子和氧分子的构成情况与题目中给定的原理即可解决此题.
解答 解:
(1)自来水厂净水过程中用到活性炭,其主要作用是吸附作用;
(2)生活中常用肥皂水来区分硬水和软水,泡沫多的是软水,泡沫少的是硬水;
(3)电解水时生成氧气和氢气,故水通电分解的化学方程式 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
根据同温同压下体积比等于分子个数比,实验生成氢气和氧气的体积比为2:1,故氢分子和氧分子的分子个数比为2:1,同时由于氢分子和氧分子都是双原子分子,所以可知水分子中氢原子和氧原子的个数比为2:1,水分子的化学式是H2O.
答案:
(1)吸附作用;
(2)肥皂水;
(3)2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;氢气与氧气的体积比约为2:1.
点评 本题主要考查电解水实验的现象和结论,解题时要依据所学知识和实验经验来解答,还要通过读题学会提取有用的信息进行推导.本题就考查的内容不难,但是根据题中信息进行合理的推导得出结论,相对要难一些,这是一种能力题,同学们要学会读题提取有用的信息.


 优学名师名题系列答案
优学名师名题系列答案科目:初中化学 来源: 题型:实验探究题
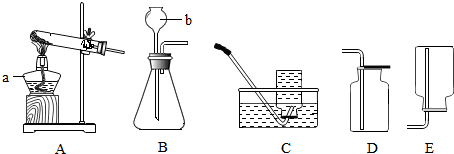
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
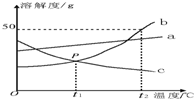 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
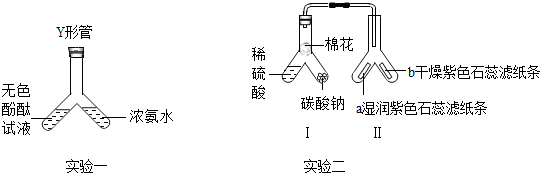
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 NaCl和KNO3两种物质的溶解度曲线如图所示.下列说法正确的是( )
NaCl和KNO3两种物质的溶解度曲线如图所示.下列说法正确的是( )| A. | t1℃时,NaCl的不饱和溶液降温一定会变成饱和溶液 | |
| B. | t2℃时,KNO3溶液降温后一定有晶体析出 | |
| C. | t1℃时,NaCl和KNO3的溶液各100 g,其溶质的质量一定相等 | |
| D. | t2℃时,KNO3饱和溶液中溶质质量分数一定大于NaCl溶液中溶质质量分数 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
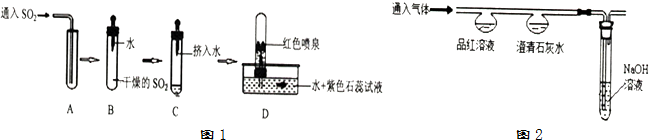
| 实验Ⅰ | 实验Ⅱ | |
| 通入CO2 | 通入SO2 | |
| 品红溶液 | 无明显变化 | 红色褪为无色 |
| 澄清石灰水 | 白色浑浊 | 白色浑浊 |
| SO2最高浓度限值(单位mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com