某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(2)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
解:(1)设12g纯碱样品中含Na
2CO
3的质量为x,生成NaCl 的质量为y
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 117 44
x y 4.4 g
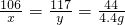
x=10.6g y=11.7g
该纯碱样品中含Na
2CO
3的质量分数为:
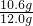
×100%=88.3%
(2)反应后所得溶液中NaCl 的质量为:12g-10.6g+11.7g=13.1g,溶液中NaCl的质量分数为:
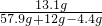
×100%=20%;
答:(1)纯碱样品中的Na
2CO
3的质量分数是88.3%;(2)反应后所得溶液中NaCl的质量分数是20%;
分析:(1)根据二氧化碳的质量算出碳酸钠的质量,再用碳酸钠的质量除以样品的质量解答即可;
(2)根据二氧化碳的质量计算出生成的氯化钠的质量,再加上原来的氯化钠质量,除以反应后总溶液质量即可解答.
点评:解答本题容易出错的地方是计算反应后所得溶液中NaCl 的质量分数时,容易忽略原来的氯化钠质量.

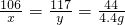
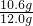 ×100%=88.3%
×100%=88.3%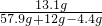 ×100%=20%;
×100%=20%;

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案