
【题目】实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】
己知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气_____g。
实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究。
【提出猜想】1.未变质 2.部分变质 3.完全变质
【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质。写出KOH变质的化学方程式为_____。
【设计实验】
(l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想_____不成立。
(2)准确称取一定质量的固体样品,放在右图所示装置中进行实验,根据CO2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由_________。
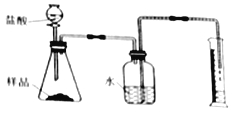
(3)请你另外设计一个方案,进一步探究变质情况
实验步骤 | 实验现象 | 实验结论 |
猜想2成立 |
【答案】探究一(4分):
实验步骤 | 实验现象 | 实验结论及解释 |
①氧气 | ||
化学性质和质量 | ||
C中产生气泡较慢 |
【拓展应用】3.2g
探究二(5分):
【查阅资料】2KOH+CO2=K2CO3+H2O
【设计实验】(l)l
(2)不可行,因为CO2能溶余水(或与水反应),导致测量结果误差较大。
(3)
实验步骤 | 实验现象 | 实验结论 |
另取少量样品,配成溶液滴加足量CuCl2溶液,静置后滴加酚酞溶液 | 产生白色沉淀 溶液变红色 | 猜想2成立 |
(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可)
【解析】探究一过氧化氢在一定条件下分解生成氧气;催化剂在能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变。红砖粉末的催化效果没有二氧化锰粉末好,所以用红砖作催化剂的试管中生成氧气的速率较慢;【拓展应用】反应后所得溶液质量为2g÷2%=100g,据质量守恒定律可知反应前后物质的总质量不变,所以生成氧气的质量为101.2g+2g-100g=3.2g探究二: 【查阅资料】KOH与空气中的二氧化碳反应生成碳酸钾和水,变质的化学方程式为2KOH+CO2=K2CO3+H2O【设计实验】(l)碳酸钾和盐酸反应生成氯化钾、水、二氧化碳,氢氧化钾和盐酸不生成气体,所以向样品中,滴加足量稀盐酸有气泡产生,说明有碳酸钾,说明氢氧化钾变质;(2)因为CO2能溶于水(或与水反应),该方法测定的二氧化碳偏少,导致测量结果误差较大。(3)可利用碳酸钾转化成沉淀的方法测定碳酸钾,用氢氧化钾溶液呈碱性,能使酚酞试液变红。具体操作现象、结论是:另取少量样品,配成溶液滴加足量CaCl2溶液,静置后滴加酚酞溶液;产生白色沉淀 ,溶液变红色;(说明:设计思路为先除尽CO32-,然后证明OH-存在。合理即可)


科目:初中化学 来源: 题型:
【题目】利用下图装置进行气体的制取实验,请回答下列问题:
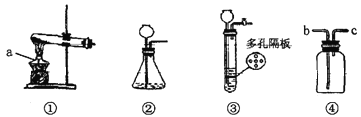
(1)写出标号a仪器的名称:________________。
(2)用氯酸钾制取氧气的化学方程式____________________,选择④装置收集氧气,气体从_______(填字母)端进入。若改用排水法收集,实验结束后先撤导气管后熄灭酒精灯,目的是防止___________________________。
(3)实验室用大理石和_________________(填写药品名称)反应制取二氧化碳。与②相比,③作为发生装置的优点是____________________,在装置④中盛放___________可用于干燥二氧化碳气体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是
A.CO 可使澄清石灰水变浑浊 B.铁制品在潮汉空气中比在干燥空气中更易腐蚀
C.合金中只有金属元素 D.金刚石和石墨的硬度都很大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】推理是一种重要的思维方法,以下推理合理的是
A.酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B.置换反应有单质生成,所以有单质生成的反应一定是置换反应
C.化学反应前后原子总数不变,所以化学反应前后分子总数也不变
D.化学反应伴随能量变化,所以金属腐蚀过程中一定伴随能量变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是人体内一些体液的正常pH值范围,其中酸性最强的体液是
液体 | 唾液 | 胃液 | 胆汁 | 胰液 |
pH | 6.6~7.1 | 0.9~1.5 | 7.1~7.3 | 7.5~8.0 |
A.胃液 B.唾液 C.胆汁 D.胰液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图1是氧元素在元素周期表中的相关信息,图2是该元素形成的一种粒子的结构示意图。

(1)元素周期表中,氧元素的原子序数为________。
(2)图2所示粒子为_________(填“离子”或“原子”)。
(3)由氧元素组成的一种气体单质可以支持燃烧,写出实验室制取该气体的一个化学方程式______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小金利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略)。
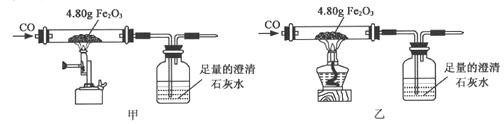
(1)从实验安全角度考虑,图示装置还应采取的改进措施是_____________。
(2)完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 称量黑色粉末质量/g | m1 | m2 |
2 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
3 | 取黑色粉末,加入稀盐酸 | 全部溶解,有大量气泡 | 无明显现象 |
4 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质生产 | 无明显现象 |
①甲组的黑色粉末与稀盐酸反应的化学方程式是__________。
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。他又发现m2恰好为_______g ,这可成为支持上述猜想的新证据。
(3)甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的__________(填写化学性质)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com