
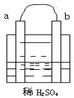
 在图所示的装置中,a的活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是.( )
在图所示的装置中,a的活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是.( )| A、碳棒上有气体放出,溶液的pH增大 |
| B、a是正极,b是负极 |
| C、导线中有电子流动,电子从a极流到b极 |
| D、a极上发生了氧化反应 |


科目:初中化学 来源: 题型:
| A、石墨是化合物 |
| B、石墨是混合物 |
| C、石墨是单质 |
| D、石墨是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、1克 | B、2克 |
| C、10克 | D、20克 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、bcde | B、abce |
| C、abcde | D、除e外 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、N2 |
| B、I2 |
| C、F2 |
| D、O3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图所示将镁条点燃后迅速伸入盛二氧化碳的集气瓶中,发现镁条剧烈燃烧,
如图所示将镁条点燃后迅速伸入盛二氧化碳的集气瓶中,发现镁条剧烈燃烧,查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验序号 | 过氧化氢 溶液浓度% |
过氧化氢 溶液体积/mL |
温度/℃ | 二氧化锰 的用量/g |
收集氧气 的体积/mL |
反应所需 的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | 2 | 49.21 | |
| 4 | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 有A、B、C、D、E五瓶失去标签的溶液,各瓶可能是Na2CO3、BaCl2、Ca(NO3)2、H2SO4(稀)、AgNO3等溶液中的一种.现将瓶内溶液各取少许,进行部分两两混合的实验,实验结果见下表(说明:表中“↑”表示有气体生成,“↓”表示有沉淀生成,“-”表示无明显现象或有微溶物生成,空格表示实验没做).
有A、B、C、D、E五瓶失去标签的溶液,各瓶可能是Na2CO3、BaCl2、Ca(NO3)2、H2SO4(稀)、AgNO3等溶液中的一种.现将瓶内溶液各取少许,进行部分两两混合的实验,实验结果见下表(说明:表中“↑”表示有气体生成,“↓”表示有沉淀生成,“-”表示无明显现象或有微溶物生成,空格表示实验没做).查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com