
| A. | 有盐和水生成的反应不一定是中和反应 | |
| B. | 由同种元素组成的物质不一定是单质 | |
| C. | 同种元素的原子和离子的质子数不一定相同 | |
| D. | 同一化合物中同种元素的化合价不一定相同 |
分析 A、中和反应是酸与碱作用生成盐和水的反应,反应物是酸和碱,生成物是盐和水.
B、由同种元素组成的纯净物是单质,进行分析判断.
C、根据同种元素的原子得失电子形成离子,进行分析判断.
D、根据常见元素的化合价,进行分析判断.
解答 解:A、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项说法正确.
B、由同种元素组成的物质不一定是单质,也可能是混合物,如氧气和臭氧的混合物,故选项说法正确.
C、同种元素的原子得失电子形成离子,其核内质子数不变,同种元素的原子和离子的质子数一定相同,故选项说法错误.
D、同一化合物中同种元素的化合价不一定相同,如在硝酸铵(NH4NO3)中氮元素的化合价分别是-3、+5,故选项说法正确.
故选:C.
点评 本题难度不大,掌握中和反应的特征、单质的特征、常见元素的化合价等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
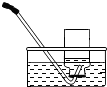 | 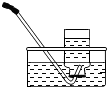 | 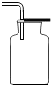 | 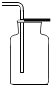 |
| 集气瓶中灌$\frac{1}{4}$的水 | 集气瓶中灌$\frac{3}{4}$的水 | 导管伸入到集气瓶体积的$\frac{1}{4}$处 | 导管伸入到集气瓶体积的$\frac{3}{4}$处 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
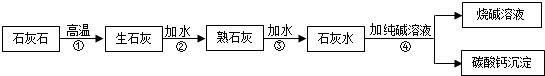
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
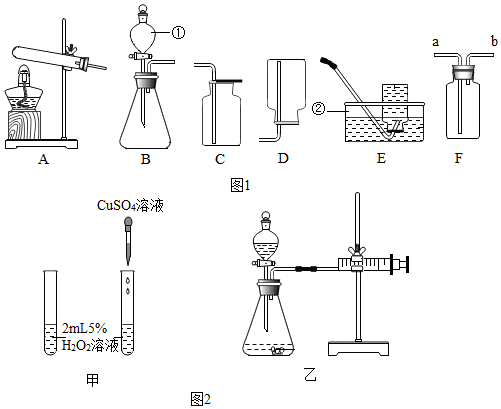
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 抗胃酸药 | 复方氢氧化镁片 | 铝碳酸镁片 |
| 有效成分 | Mg(OH)2 | AlMg(OH)3CO3 |
| 构成微粒 | Mg2+、OH- | Al3+、Mg2+、OH-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com