
【题目】化学在防治环境污染方面起着重要作用。某发电厂用石灰石浆吸收燃煤废气中二氧化硫,反应原理为:2CaCO3 + 2SO2 + O2 = 2CaSO4 + 2CO2。原料使用的碳酸钙粉末价格是400元/吨,处理过程中回收的硫酸钙价格是700元/吨。
(1)若该厂每天可回收2.72 t硫酸钙,则可处理的二氧化硫质量是多少?_____
(2)回收硫酸钙的价值______(填“大于”、“等于”或“小于”)原料碳酸钙粉末的价值。
科目:初中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是___。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__。
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO![]() Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C![]() 2CO
2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)____,不属于氧化还原反应的有____。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式:___,___。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO310H2O与CuSO45H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO45H2O、16.0gNa2CO310H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是___。
②撤离热源的目的是___。
组成测定:
有同学查阅资料发现用Cu(OH)2CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
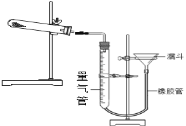
③三次平行实验测定结果如下表,则该样品中m:n=___,若量气管中所盛液体是水,则该测定值比理论值___(填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 | 样品质量/g | CO2体积/mL (已折算成标准状况下) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
查看答案和解析>>
科目:初中化学 来源: 题型:
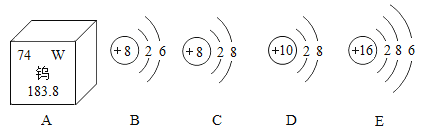
【题目】2019年3月20日中国科普网报道:元素之旅科普活动结束,化学那点事儿引超3100万次点击,让枯燥生硬的科学知识变得亲切而有趣,也让科学知识更易于传播和分享。如图A是钨元素在元素周期表中的信息,B﹣E是四种粒子的结构示意图。
请回答
(1)从A中可知,钨元素的相对原子质量_____。
(2)钨属于有色金属,是国际上重要的战略金属,江西浮梁县朱溪钨矿查明三氧化钨(WO3)资源量286万吨,成为新的世界最大钨矿。在高温条件下用氢气还原三氧化钨就可以制得金属钨,请写出制取钨的反应化学方程式_____。
(3)B﹣E四种粒子中:①属于同种元素的粒子是_____(填字母,下同);②具有相对稳定结构的粒子是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】把握微观世界,了解物质构成的奥秘,能帮助我们更好的认识物质变化的本质![]() 如图是某化学反应的微观模拟图:
如图是某化学反应的微观模拟图:
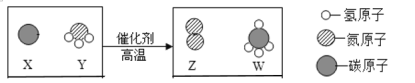
⑴ 反应物中的单质的化学式为______。
⑵ 该反应的化学方程式为__________________________________________,属于______反应![]() 填基本反应类型
填基本反应类型![]() 。
。
⑶ 通过该图你能获得的信息有____________________________________。
⑷ 物质W中两种元素的质量比为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产生活中起着十分重要的作用。
(1)“直饮水机”可将自来水净化为饮用水,其内部使用的活性炭主要起______作用。实验室常用______方法降低水的硬度。
(2)C1O2是饮用水常用的消毒剂。制取C1O2的反应如下:C12+2NaC1O2=2C1O2+2X,则X的化学式为______。
(3)食盐水能导电是由于食盐溶于水形成______。
(4)如图是甲、乙两种不含结晶水的固体物质的溶解度曲线。
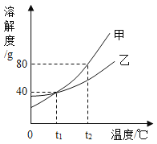
①t1℃时,甲物质的溶解度是_____g。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是_____ (填“甲”或“乙”)物质的饱和溶液。
③t2℃时,将一瓶溶质质量分数为10%的乙溶液,蒸发掉60 g水后,溶质质量分数变为20%,则原溶液中溶质的质量为_____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行。

(1)体育馆内照明电路中的导线大多数是铜导线,用铜做导线是利用金属铜的__性和__性。
(2)体育馆雄伟壮观的主题建筑使用了大量的金属铝板。铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式是__。
(3)本届锦标赛吉祥物“南南”和“宁宁”,其外材料为纯羊毛,内充PET纤维(化学式为(C10H8O4)n),PET纤维由____种元素组成。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“质量守恒定律”的课堂教学中,教师引导学生进行“化学反应中,反应物与生成物的质量关系”的实验探究。甲、乙、丙、丁四个组的同学分别规范地完成了如下图所示的A、B、C、D四个实验,请回答下列问题。
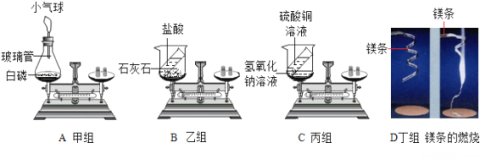
(1)四个小组分别在反应结束后进行了称量,只有丙组的C实验天平平衡,说明质量守恒, 微观解释其守恒的原因是_____;甲组的A实验在老师的引导下,也使天平平衡了,其初次称量不平衡的原因可能是____。
(2)教师引导学生分析了B、D两个实验天平不平衡的原因。同学们在分析B实验后一致认为该实验应在密闭体系中进行实验,防止____;在分析D实验不平衡的原因时出现了实验结果与分析的结果恰好相反的情况,即称量镁条燃烧的产物小于镁条的质量,经过分析得出该结果的原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
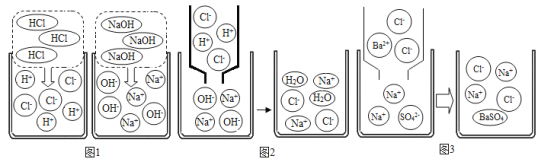
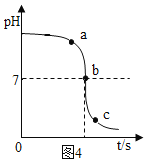
(1)如图4是氢氧化钠溶液与盐酸反应时溶液pH变化的示意图。根据图示判断,该实验是将_____(填“氢氧化钠溶液”或“盐酸”)滴加到另一种溶液中。a点pH_____7,c点的溶质是_____。
(2)如果将盐酸滴入氢氧化钠溶液(加入酚酞试液),完全反应时,溶液呈_____色。它们反应前后的微观示意图如图。图1是HCl和NaOH在水中解离出离子的示意图,HCl在水中会解离出H+和Cl﹣,可以表示为HCl→H++Cl﹣,NaOH在水中解离可表示为_____。图2是氢氧化钠溶液与盐酸反应的微观示意图,该反应的实质可表示为_____
(3)BaCl2在水中会解离出的离子是_____(填符号)。图3是氯化钡溶液与硫酸钠溶液反应的微观示意图,该)反应的实质可表示为_____。由此类推,硫酸溶液与碳酸钠溶液反应的实质可表示为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表中铝元素的部分信息如图甲所示,其原子结构示意图如图乙所示。下列结论不正确的是
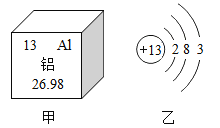
A. 铝的原子序数是13 B. 该原子在化学反应中易得电子
C. 铝的相对原子质量为26.98 D. 化学反应中铝原子易失电子变成Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com