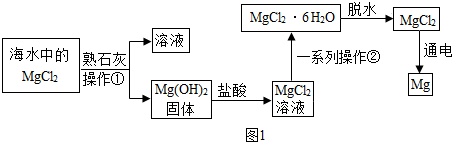
9.某兴趣小组同学从海水晒盐后的盐卤中模拟工业生产来提取镁,主要流程如图1:
【问题讨论】
(1)流程中的操作①需要用到的玻璃仪器是:玻璃棒、烧杯和漏斗.
(2)一系列操作②中包含蒸发浓缩、降温结晶、过滤等.
(3)电解氯化镁可以得到镁和氯气,该反应的化学方程式为:MgCl
2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl
2↑,该变化过程是电能转化为化学能.
(4)镁的化学性质比较活泼,能在氮气中燃烧生成氮化镁,在氮化镁中氮元素的化合价为-3,则氮化镁的化学式为:Mg
3N
2.
【发现问题】镁是一种银白色有金属光泽的金属.但拿出的镁条总是有一层灰黑色的“外衣“,这层灰黑色的外衣是什么物质呢?
【查阅资料】(1)Mg(OH)
2:白色固体,难溶于水,受热会分解成氧化镁和水;
(2)MgCO
3:白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
(3)MgCO
3的热稳定性比Mg(OH)
2的热稳定性更强.
【提出猜想】
小组同学认为该固体不可能是MgO、Mg(OH)
2或MgCO
3,他们的理由是MgO、Mg(OH)
2或MgCO
3均为白色固体,镁条外面是灰黑色;
小组同学由铜生锈会产生Cu
2(OH)
2CO
3联想到灰黑色的物质可能是Mg
2(OH)
2CO
3.
【实验分析】
按图2所示装置进行实验,发现试管口有液滴出现,说明反应产生了水;澄清石灰水变浑浊(变浑浊
的化学方程式为CO
2+Ca(OH)
2=CaCO
3↓+H
2O);同时灰黑色固体完全变为白色.若灰黑色固体是Mg
2(OH)
2CO
3,请写出Mg
2(OH)
2CO
3受热分解的化学方程式Mg
2(OH)
2CO
3$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+H
2O+CO
2↑.
【组成测定】
工业生产中得到的碱式碳酸镁晶体是xMgCO
3•yMg(OH)
2•zH
2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,最后完全反应),测定剩余固体质量与分解温度之间关系.
【数据处理】剩余固体质量与加热时间关系如图3所示:
请回答下列问题:
(1)0~t
1固体质量没有发生变化的原因可能是温度没有达到晶体分解所需的最低温度.
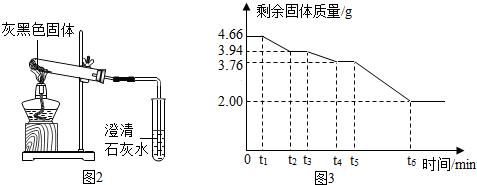
(2)晶体中结晶水的质量为0.72gg.
(3)t
4~t
5段固体为MgCO
3和MgO(写化学式).
(4)根据图中数据推算xMgCO
3•yMg(OH)
2•zH
2O中x:y:z的最简比=4:1:4.



 阅读快车系列答案
阅读快车系列答案