
现有下列装置,回答问题:
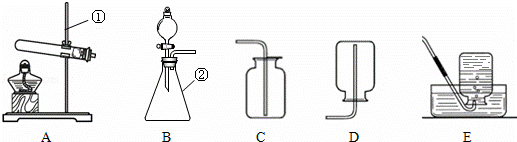
(1)写出有标号仪器的名称:① ;② ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 发生装置为 ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验.
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b |
[实验内容]:
[实验分析]:
①完善上表中的填空内容:a 、b ;
②实验2的目的是 ;
③经讨论,实验1的结论不正确,理由是 ;
[资料]:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4 KMnO2+O2↑
KMnO2+O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 (填“a”或“b”)为主.
| (1)据常用仪器回答; (2)据检查装置气密性的方法回答; (3)H2O2溶液和MnO2生成氧气和水,该反应不需加热,属于固液常温型; (4)据氧气的密度和溶解性选择收集装置; (5)根据实验内容可知,是要检验高锰酸钾分解的产物中是否有MnO2、是否催化分解H2O2,实验2是与实验1对比,确定MnO2是否起催化作用,实验3是分析反应产物中是否有MnO2,从而反映出实验1不严密,也可能是分解后的其他物质起催化作用; Ⅱ、据所给信息:KMnO4受热分解时,会发生以下两个反应,可据方程式分别计算出若发生单一反应生成氧气的质量,因为两个反应同时发生,所以生成氧气的质量应在二者之间; 据KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%,结合以上方程式计算失重率,推测发生的主要化学反应. | |
| 解答: | 解:(1)标号仪器分别是铁架台、锥形瓶; (2)检查B装置的气密性的方法是:堵住右侧导气管,打开分液漏斗活塞,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气; (3)H2O2溶液和MnO2生成氧气和水,方程式是2H2O2 (4)氧气的密度比空气大且不易溶于水,可用向上排空气法或排水法收集; (5)①实验2是与实验1对比,确定MnO2是否起催化作用,则所取H2O2溶液的溶质质量分数应相同,实验3取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤后固体完全溶解,说明不含MnO2,因为MnO2不溶于水; ②实验2是与实验1作对比,确定MnO2是否起催化作用; ③由实验3可知反应产物中是否有MnO2,从而反映出实验1不严密,也可能是分解后的其他物质起催化作用; ④若发生的是a反应,设8.0gKMnO4,加热使之完全分解,生成O2的质量为x 6KMnO4 6×158 4×32 8.0g x
x=1.08g 若发生的是b反应,设8.0gKMnO4,加热使之完全分解,生成O2的质量为y KMnO4 158 32 8.0g y
y=1.62g 因为KMnO4受热分解,会发生以上两个反应,所以生成氧气的质量介于1.08g和1.62g之间,故C选项正确; ⑤由题意可知:KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0%,据方程式可知:在a反应中失重率为: 故答案为:(1)铁架台; 锥形瓶; (2)打开分液漏斗活塞; (3)2H2O2 (4)C或E; (5)①a:6%;b:KMnO4分解后的产物中没有MnO2; ②和实验1进行对比,确定MnO2是否为起催化作用; ③可能是分解后产物中其他物质起催化作用; ④C; ⑤b. |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
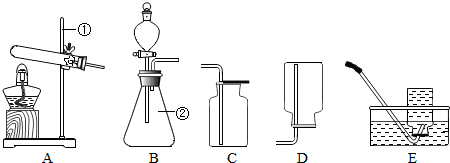
| ||
| ||
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a a (H2O2质量分数)的H2O2溶液中 |
平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b b |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:
现有下列装置,回答问题:
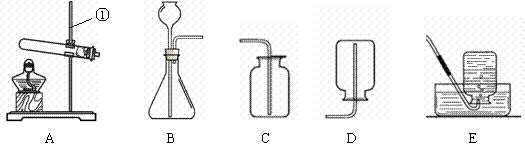 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
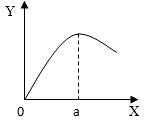
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com