
【题目】2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具。
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示。
第1周期 | H | He | ||||||
第2周期 | Li | Be | B | C | N | O | F | Ne |
第3周期 | Na | Mg | Al | Si | P | S | Cl | Ar |
①Al属于_____(填“金属”或“非金属”)元素,其原子的核电荷数为______
②Na原子的结构示意图为 ,则钠离子的核外电子数为_______。
,则钠离子的核外电子数为_______。
③周期表中磷元素的有关信息如图所示,图中“30.97”所表示的含义是_______.

(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价一物质类别”关系图。
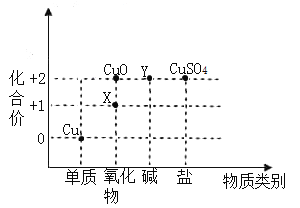
①写出物质X的化学式:_____。
②写出由物质Y转化为![]() 的化学反应方程式:______.
的化学反应方程式:______.
【答案】金属 13 10 磷原子的相对原子质量 Cu2O Cu(OH)2+H2SO4=CuSO4+2H2O
【解析】
(1)①Al的元素名称带有金字旁,属于金属元素,故填金属;
Al的原子序数为13,原子序数=原子核的核电荷数,所以其核电荷数为13,故填13。
②由图可知,钠原子核外有11个电子,其中最外层电子数为1,在化学反应中容易失去1个电子,形成核外有10个电子的钠离子,故填10。
③元素周期表的元素信息方格中元素名称下方的数字是元素原子的相对原子质量,即30.97是磷原子的相对原子质量,故填磷原子的相对原子质量。
(2)①由图可知,X属于氧化物,且其中铜元素的化合价为+1价,氧元素的会为-2价,利用十字交叉法,则X的化学式为Cu2O,故填Cu2O。
②由图可知,Y中铜元素的化合价为+2价,属于碱,所以Y为氢氧化铜,氢氧化铜与硫酸反应生成硫酸铜和水,故反应的化学方程式写为:Cu(OH)2+H2SO4=CuSO4+2H2O。


科目:初中化学 来源: 题型:
【题目】高阳同学通过阅读课外资料得知,潜水艇中常用过氧化钠(Na2O2)作为供氧剂,有关反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2H2O═4NaOH+O2↑。于是她用如图所的装置来制取CO2并验证其与Na2O2的反应。
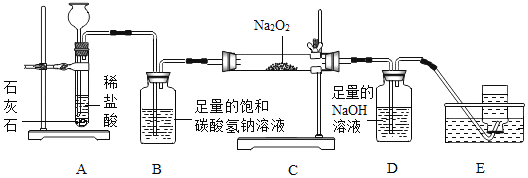
(1)装置B的作用是_____。
(2)反应一段时间后,装置E中收集到的气体主要是_____;反应后装置C硬质玻璃管中固体的成分是什么?高阳为此又进行了如下探究:
(猜想与假设)
猜想一 Na2CO3
猜想二Na2CO3和Na2O2
猜想三Na2CO3和NaOH
你认为还可能是_____
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量样品于试管中,加入足量的水,振荡 | 固体完全溶解,_____ | 样品中一定没有Na2O2 |
②取少量实验①所得溶液于另一试管中,加入过量的BaCl2溶液,振荡 | 有白色沉淀产生 | 猜想三正确 |
③取少量实验②所得上层清液于另一试管中,加入_____溶液,振荡 | 有白色沉淀产生 |
(反思与评价)反应后装置C硬质玻璃管中的固体含有NaOH,原因可能是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种均不含结晶水的固体物质(设它们从溶液中析出时也都不含结晶水)的溶解度曲线如右图所示。下列说法正确的是( )
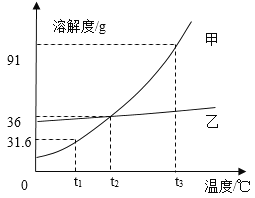
A. t1℃时,将甲、乙各17g分别加入到50g水中,所得两溶液的质量相等
B. 将甲、乙两种溶液由t3℃降温至t2℃,所得两溶液中溶质质量分数一定相等
C. 若甲中混有少量的乙,可先配制较高温度下甲的饱和溶液,再采用降温结晶的方法提纯甲
D. 将t3℃时甲的饱和溶液100g降温至t1℃,析出甲的质量是59.4g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合图示回答下列问题。
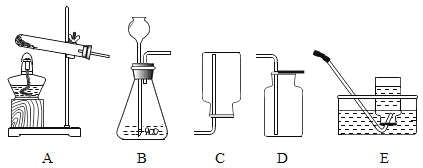
(1)上列图示各仪器中,金属仪器的名称是_____。
(2)实验室常用氯酸钾和二氧化锰固体混合制取氧气,发生反应的化学方程式为_____,上图中可以选用的发生装置是_____(填序号),如果选择E作收集氧气的装置,则当气泡_____时开始收集。
(3)若用过氧化氢溶液制取氧气,则可以选用的制取装置是_____(填序号),其反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】称取m g ![]() (相对分子质量为146,其中氧元素的化合价为-2)置于氮气流中加热残留固体质量随温度的变化如图所示(图中各点对应固体均为纯净物),其中
(相对分子质量为146,其中氧元素的化合价为-2)置于氮气流中加热残留固体质量随温度的变化如图所示(图中各点对应固体均为纯净物),其中![]() 发生反应:
发生反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
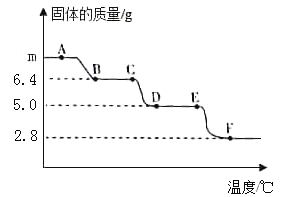
A. ![]() 中碳元素的化合价为+2
中碳元素的化合价为+2
B. ![]()
C. ![]() 发生反应的化学方程式为
发生反应的化学方程式为![]()
D. F点对应固体的化学式为![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用如图所示装置进行下列实理验,实验结果与预测的现象不一致的是( )
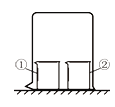
选项 | ①中的物质 | ②中的物质 | 预测①中的现象 |
A | 紫色石蕊试液 | 浓氨水 | 溶液由紫色变为蓝色 |
B | 氢氧化钡溶液 | 浓硫酸 | 有白色沉淀 |
C | 硫酸铜溶液 | 浓氨水 | 有蓝色沉淀 |
D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳铵是一种常用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
(查阅资料)氨气具有刺激性气味,极易溶于水,其水溶液呈碱性;氨气能使湿润的红色石蕊试纸变蓝;氨气不与碱石灰反应。
Ⅰ.检验溶液中的阴,阳离子。
取少量碳铵放入试管中,加入盐酸,把生成的无色无味的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓![]() 溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有的阴离子可能是_______和_________(填离子符号)
(2)根据实验现象,碳铵与浓![]() 溶液加热反应生成了________(填化学式)气体。
溶液加热反应生成了________(填化学式)气体。
Ⅱ.测定碳铵中C元素和N元素质量比,在此过程中,用到如图一所示装置。请回答:
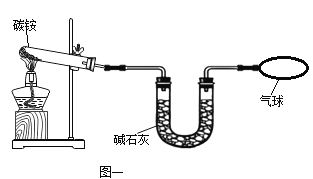
(3)给碳铵固体加热时,试管口略向下倾斜的原因是_______________。
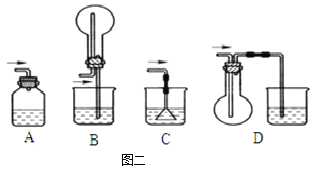
(4)从安全和环保的角度考虑,本实验可以用如图一所示的气球来收集尾气,还可以选用如图二所示的_______(填序号)装置来处理尾气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是___________。
A 只有固体 B 只有液体
C 只有气体 D 气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为___________,水的体积为_________mL (水的密度近似看作lg/cm3)。
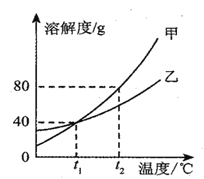
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如下图.t1℃时,甲物质的溶解度是___________。t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是___________ (填“甲”或“乙”)物质的饱和溶液。
(4)下列说法正确的是___________。
A.将甲物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
B.将t2℃时甲、乙物质的溶液降温到t1℃,其溶液的质量一定相等
C.配制一定溶质质量分数的乙物质溶液,若量取水时俯视读数,其它操作均正确,则配制的乙溶液中溶质的质量分数将偏高
选项 | x | y |
A | 水 | 氧化钙 |
B | 水 | 硝酸铵 |
C | 浓硫酸 | 水 |
D | 稀盐酸 | 镁 |
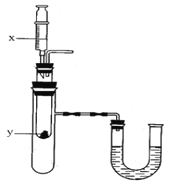
(5)按上图所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为“测定空气里氧气含量”,小明同学取足量的红磷、镁条、木炭分别在等体积的A、B、C三瓶空气中同时燃烧,充分燃烧后恢复到常温再松开止水夹,发现集气瓶B中进水最多,C中进入水量很少。(已知:镁条在空气中点燃会与氧气发生反应生成白色固体氧化镁,还会与氮气发生反应生成黄色固体氮化镁。)
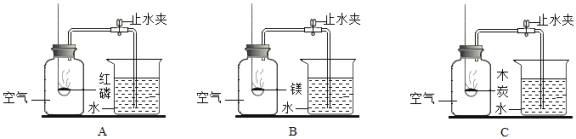
(1)A、B装置中有一处明显的错误为_____,写出C装置中反应的文字表达式_____。
(2)实验中红磷、镁条、木炭都用足量的目的是_____。
(3)水停止倒吸后发现集气瓶B中的水量明显高于集气瓶A的原因是_____。
(4)从以上实验说明在测定空气中氧气含量实验中,药品的选择除了需要足量外,还要考虑哪些因素:_____、_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com