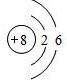
解:(1)①氧原子的核内质子数为8,核外有2个电子层,第一层上有2个电子,第二层上有6个电子,其原子结构示意图为
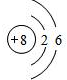
.
②由离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;3个亚铁离子可表示为:3Fe
2+.
③硫酸铝中铝元素显+3价,硫酸根显-2价,其化学式为Al
2(SO
4)
3.
④氢氧化钠中的阴离子是氢氧根离子,其离子符号为:OH
-.
⑤由元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,+2价的钙元素可表示为:
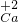
.
⑥氦气属于稀有气体单质,直接用元素符号表示其化学式,其化学式为He.
(2)标在分子符号前面的数字表分子的个数,标在化学式中元素右下角的数字表示一个分子在所含原子的数目,“2O
3”中数字的含义:①“2”表示2个臭氧分子;②“3”表示一个臭氧分子中含有3个氧原子.
(3)根据反应的化学方程式C
2H
8N
2+2R═3N
2+4H
2O+2CO
2,反应物中碳、氢、氮原子个数分别为2、8、2,反应后的生成物中碳、氢、氮、氧原子个数分别为2、8、6、8,根据反应前后原子种类、数目不变,则2R中含有4个氮原子和8个氧原子,则每个R分子由2个氮原子和4个氧原子构成,则物质R的化学式为N
2O
4.
(4)纯净的氢气在氧气中燃烧的化学方程式为:2H
2+O
2
2H
2O,该反应中氢气、氧气、水的质量比是4:32:36=1:8:9.
(5)在反应2X+Y
2=2Z中,已知X的相对分子质量为24,Y
2的相对分子质量为32,设Z的相对分子质量为x,则24×2+32=2x,x=40.
(6)在化学反应A+2B=C中,1.5gA与适量的B充分反应生成9.5gC,则参加反应的B的质量为9.5g-1.5g=8g.
故答案为:(1)①
;②3Fe
2+;③Al
2(SO
4)
3;④OH
-;⑤
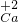
;⑥He;
(2)2个臭氧分子;一个臭氧分子中含有3个氧原子
(3)N
2O
4;(4)1:8:9;(5)40;(6)8.
分析:(1)①氧原子的核内质子数为8,画出其原子结构示意图即可.
②根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;进行书写.
③根据化合物化学式的书写方法进行书写即可.
④氢氧化钠中的阴离子是氢氧根离子,写出其离子符号即可.
⑤根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行书写.
⑥根据单质化学式的书写方法进行书写即可.
(2)标在分子符号前面的数字表分子的个数,标在化学式中元素右下角的数字表示一个分子在所含原子的数目.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R的化学式.
(4)根据化学方程式中各物质的质量比等于相对分子质量和的比进行分析解答.
(5)在反应2X+Y
2=2Z中,设Z的相对分子质量为x,根据质量守恒定律进行分析解答.
(6)由质量守恒定律进行分析解答.
点评:本题难度不大,掌握常见化学用语的书写方法、质量守恒定律并能灵活运用是正确解答本题的关键.

 .
.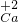 .
. 2H2O,该反应中氢气、氧气、水的质量比是4:32:36=1:8:9.
2H2O,该反应中氢气、氧气、水的质量比是4:32:36=1:8:9. ;②3Fe2+;③Al2(SO4)3;④OH-;⑤
;②3Fe2+;③Al2(SO4)3;④OH-;⑤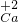 ;⑥He;
;⑥He;

 化学用语是高度浓缩的符号体系,可准确简洁的记录、表达、交流化学信息.
化学用语是高度浓缩的符号体系,可准确简洁的记录、表达、交流化学信息. 所表示的粒子名称是
所表示的粒子名称是