
分析 根据MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O可看出:所得固体质量为MgCl2与NaCl混合物解答
解答 解:设原固体混合物中MgCO3、NaHCO3、NaCl质量分别为x、y、z
MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O
84 95 84 58.5
x $\frac{95x}{84}$ y $\frac{58.5y}{84}$
由题意可知:
x+y+z=10g
$\frac{95x}{84}+\frac{58.5y}{84}$+z=10g
解答:x:y=51:22
答案:51:22
点评 本题考查混合物反应的计算,题目难度中等,侧重对学生分析思维与解题方法技巧考查,注意守恒法在化学计算中的应用.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:解答题
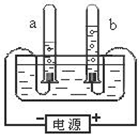 实验是化学学习的一种重要 手段,如利 用电解水实验可探究水的组成.请根据电解水实验回答下列问题:
实验是化学学习的一种重要 手段,如利 用电解水实验可探究水的组成.请根据电解水实验回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金刚石和石墨物理性质差异很大:碳原子排列方式不同 | |
| B. | 20mL酒精和20mL水混合后体积小于40mL:分子之间存在间隔 | |
| C. | 碳元素和氧元素属于不同种元素:质子数不同 | |
| D. | 温度计受热时水银柱上升:受热时汞原子体积变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 钠原子易失去电子,氯原子易得到电子 | |
| B. | 钠和氯气反应生成氯化钠 | |
| C. | 氯化钠是纯净物 | |
| D. | 钠离子和钠原子的化学性质相似 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | O2 | B. | CO | C. | CO2 | D. | H2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
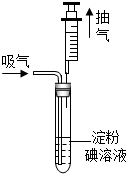 某地规定工业排放的废气中S02的含量不得超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中S02的含量,测试装置如图所示.
某地规定工业排放的废气中S02的含量不得超过0.4mg/L.某兴趣小组利用以下反应:SO2+I2+2H2O=H2SO4+2HI,测定某工业废气中S02的含量,测试装置如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com