钢铁工业是国家工业的基础.
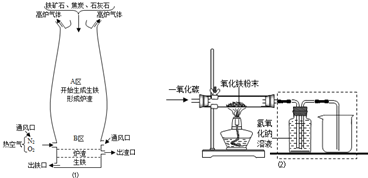
(1)如图是教材中炼铁高炉及炉内化学变化过程示意图,根据图1示回答下列问题.
若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:
A区
;B区
,
.
(2)某兴趣小组在实验室中模拟炼铁化学原理的实验,对固体产物成分等进行探究.
【设计实验】
用一氧化碳还原纯净的氧化铁粉末,实验装置如图2.
【进行实验】
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
【分析与讨论】
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
③各物质的相关性质如下表:
| 物质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和
.
②进行猜想:黑色固体粉末可能a.全部为铁 b.
c.
.
【得出结论】
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)
.
【反思与评价】
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有
.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.




 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
 全球低碳行动吉祥物“碳宝”(见图)蕴含绿色经济、低碳经济和节能减排的内涵.下列做法中碳宝不赞同的是( )
全球低碳行动吉祥物“碳宝”(见图)蕴含绿色经济、低碳经济和节能减排的内涵.下列做法中碳宝不赞同的是( )