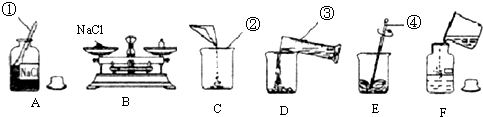
解:(1)根据图示可知,①是药匙,②是烧杯,③是量筒,④是玻璃棒;
(2)配制50g5%的氯化钠溶液,所需氯化钠的质量为50g×5%=2.5g,称量时若指针偏右,说明药品的量不足,所以应继续添加药品;
(3)所需水的质量为50g-2.5g=47.5g,其体积为47.5mL,量筒应选择1--mL的,减小误差,读数时视线要与凹液面最低处保持水平,即平视;
(4)溶解时玻璃棒的作用是搅拌,加速氯化钠的溶解;
(5)①B操作中砝码和NaCl放错托盘,即物码倒置,则所称氯化钠的实际质量为砝码的质量-游码的质量,溶质的质量减少,所以溶质的质量分数偏低;
②C操作中烧杯内壁原来附着有水珠,造成所配溶液质量增加,溶质的质量不变,所以溶质的质量分数偏低;
③D操作时有少量水溅出,造成溶液的质量减少,而溶质的质量不变,所以溶质的质量分数偏高;
④D操作中仰视凹液面的最低处读数,实际量取的液体>47.5mL,溶质的质量不变,所以溶质的质量分数偏低;
⑤D操作中量筒内壁原来附有少量水珠,不影响量取液体的体积,溶质和溶剂的质量不变,所以溶质的质量分数不变;
⑥F操作中溶液已配制好,溶液具有均一性,所以洒落不影响溶质的质量分数.
故答案为:
(1)药匙; 烧杯; 量筒; 玻璃棒;
(2)2.5; 继续添加氯化钠粉末;
(3)47.5; 100mL; 凹液面最低处;
(4)搅拌,加速氯化钠粉末的溶解速度;
(5)①②④; ③; ⑤⑥.
分析:(1)根据常用仪器的名称和用途解答;
(2)根据溶质的质量=溶液的质量×溶质的质量分数进行计算,称量时若指针偏右,说明药品的量不足;
(3)根据溶剂的质量=溶液的质量-溶质的质量,m=ρv计算水的体积,选择量筒选取与所量液体体积相近的量筒,读数时视线要与凹液面最低处保持水平;
(4)溶解时玻璃棒的作用是搅拌,加速物质的溶解;
(5)根据溶质的质量分数=

×100%进行判断.
点评:本题主要考查了配制一定溶质质量分数的溶液所用的仪器,操作及实验误差分析,较好的考查了学生分析解决问题的能力,要求同学们能熟练掌握溶液配制的步骤和所需要的仪器,以便灵活应用.

 ×100%进行判断.
×100%进行判断.