
【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。化学小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2=2K2CO3+2I2
乙:4KI+O2+2H2O=4KOH+2I2
Ⅱ.KOH与NaOH的化学性质相似。
为探究碘化钾变质原理的合理性,开展以下实验。
(实验过程)
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
①石灰水变浑浊的原因是______(用化学方程式表示)。
②化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是______。
[实验2]如图1所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。

③据此现象,可得出的结论是______。
[实验3]按图2所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。
化学小组据此改进实验,很快观察到固体泛黄的现象。
(实验结论)④根据上述实验,化学小组得出结论,碘化钾固体泛黄变质是碘化钾与______共同作用的结果。
【答案】![]() 无法判断K2CO3是按反应甲原理产生的,还是按反应乙原理生成的KOH又与空气中二氧化碳反应生成K2CO3 氧气和水不能使碘化钾变质 氧气、水和二氧化碳
无法判断K2CO3是按反应甲原理产生的,还是按反应乙原理生成的KOH又与空气中二氧化碳反应生成K2CO3 氧气和水不能使碘化钾变质 氧气、水和二氧化碳
【解析】
①二氧化碳能和石灰水反应生成不溶于水的碳酸钙和水,这是石灰水变浑浊的原因,化学方程式为:![]() ;
;
②碘化钾直接变质可以生成碳酸钾,碘化钾变质生成的氢氧化钾,吸收二氧化碳也会生成碳酸钾,通过澄清石灰水变浑浊的现象,不能判断碳酸钾是如何转化成的,所以,理由是:无法判断K2CO3是按反应甲原理产生的,还是按反应乙原理生成的KOH又与空气中二氧化碳反应生成K2CO3;
③按如图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象,可得出的结论是:氧气和水不能使碘化钾变质;
④根据上述实验,化学小组得出的结论:碘化钾固体泛黄变质是碘化钾与氧气、水和二氧化碳共同作用的结果。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】铜狮人类最早利用的金属之一。
(1)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为______________。
利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件己略去):已知:
2Cu+2H2SO4+O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
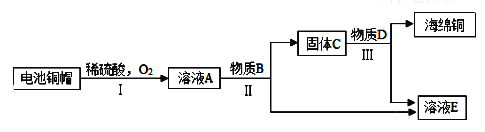
(2)①过程Ⅱ中分离操作的名称是______.
②过程Ⅲ中有气体产生,反应的化学方程式为______.
③A~E中含铜、锌两种元素的物质有______(填字母序号).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,若向小试管(试管中装有水)中分别加入一定量的下列物质,U型管中的液面左升右降,则该物质是( )
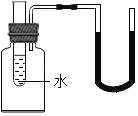
A. 浓硫酸B. 硝酸铵固体C. 氧化钙固体D. 氯化钠固体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图表示的是甲、乙两种物质的溶解度曲线,据图所示,下列说法正确的是( )
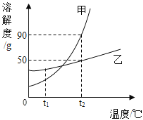
A. t2℃时,甲乙两物质饱和溶液中的溶质质量大小关系是甲>乙
B. 若甲物质中混有少量的乙物质,可以采用降温结晶的方法提纯甲物质
C. t2℃时将30g乙物质加入到50g水中,所得溶液的质量为80g
D. 将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,溶液中的溶质质量分数大小关系是甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图表示的是甲、乙两种物质的溶解度曲线,据图所示,下列说法正确的是( )
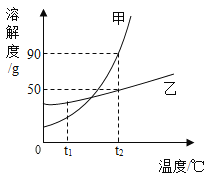
A. t2℃时,甲乙两物质饱和溶液中的溶质质量大小关系是甲>乙
B. 若甲物质中混有少量的乙物质,可以采用降温结晶的方法提纯甲物质
C. t2℃时将30g乙物质加入到50g水中,所得溶液的质量为80g
D. 将t1℃的甲、乙两物质的饱和溶液(均无固体物质剩余)升温到t2℃时,溶液中的溶质质量分数大小关系是甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年1月3日,嫦娥四号探测器在人类史上第一次实现了月球背面着陆。在月球广泛分布的岩石中,蕴藏着丰富的钛、镍等矿产。元素周期表中钛、镍两种元素的相关信息如图所示,对图中信息解释不正确的是( )
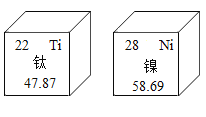
A. 钛、镍均属于金属元素
B. 钛原子核内中子数为22
C. 镍原子核外电子数为28
D. 镍原子的相对原子质量为58.69
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的稀盐酸加入氢氧化钙溶液一会儿后,发现忘记滴加指示剂,因此,他们停止滴加氢氧化钙溶液,并对烧杯内溶液中的溶质成分进行探究
(提出问题)该烧杯内溶液中的溶质是什么?
(提出猜想)猜想①:可能是CaCl2和Ca(OH)2;猜想②:_____猜想③可能是CaCl2和HCl
(查阅资料)氯化钙溶液呈中性。
(实验探究)
实验步骤 | 实验现象 | 结论 |
取少量烧杯内溶液于试管中,滴入几滴酚酞溶液 | _____ | 猜想①不成立 |
取少量烧杯内溶液于试管 中逐滴加入Na2CO3溶液 | _____ | 猜想②成立 |
_____ | 猜想③成立 |
(反思)(1)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑_____。
(2)若猜想③正确,要处理烧杯内溶液使其溶质只含有CaCl2,应向烧杯中加入过量的_____(化学式)。
(3)验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质或者方法单独使用也能完成该实验_____?
A.pH试纸 B.镁条 C.检查导电性 D.铜片
(拓展延伸)(注意:若答对(拓展延伸)奖励4分,化学试卷总分不超过60分。)
(1)在进行酸碱中和反应实验的过程中,研究性小组取一定量的稀盐酸,逐滴匀速滴加氢氧化钙溶液,用pH和温度电子传感器实时获得的pH、温度曲线(如图),由图你得到的认识,
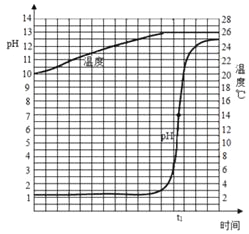
请写出两条①_____②_____。
(2)微粒观是化学基本观念的重要组成部分,也是化学基本观念中最基础的部分,从微观视角认识和考察物质世界是研究化学应掌握的重要思维方法,试从微观角度分析酸碱中和反应的实质是_____。由中和反应实质可以知道部分离子在水溶液中不能共存,请再写出一组不能共存的离子_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业废料石膏![]() 可以“变废为宝”,用于生产氧化钙、硫酸钾、电石等。某研究性学习小组展开了如下系列研究:
可以“变废为宝”,用于生产氧化钙、硫酸钾、电石等。某研究性学习小组展开了如下系列研究:
一、高纯CaO的制备
(资料一)
Ⅰ![]() 无水硫酸铜遇水变成蓝色的硫酸铜晶体。
无水硫酸铜遇水变成蓝色的硫酸铜晶体。
Ⅱ![]() 石膏
石膏![]() 与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅲ![]() 能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去。
能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去。
甲同学用如下装置制备CaO并验证石膏与焦炭高温反应的其他产物。
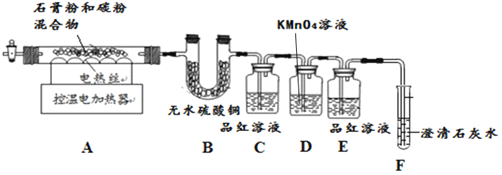
实验过程中发现:B中无水硫酸铜变蓝,说明有______生成;C中产生溶液褪色现象证明有![]() 生成;装置______中无明显变化和装置F中______现象证明有
生成;装置______中无明显变化和装置F中______现象证明有![]() 生成。写出石膏与碳粉在高温条件下反应的化学方程式:______。
生成。写出石膏与碳粉在高温条件下反应的化学方程式:______。
二、硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如下:
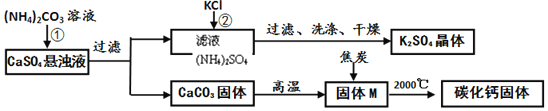
(资料二)常温下,![]() 能溶于水,温度升高,溶解度变大;
能溶于水,温度升高,溶解度变大;
氧化钙与焦炭在高温下反应生成碳化钙和一氧化碳。
![]() 反应
反应![]() 的化学方程式为______。证明固体M中不含
的化学方程式为______。证明固体M中不含![]() 的方法是______
的方法是______![]() 写出实验的方法、现象
写出实验的方法、现象![]() 。
。
![]() 反应
反应![]() 的化学方程式为
的化学方程式为![]() ,为得到纯净的硫酸钾晶体,洗涤反应
,为得到纯净的硫酸钾晶体,洗涤反应![]() 所得晶体是必不可少的步骤。但工业上不用水而用饱和
所得晶体是必不可少的步骤。但工业上不用水而用饱和![]() 溶液洗涤反应
溶液洗涤反应![]() 所得晶体,其目的是______。
所得晶体,其目的是______。
三、研究![]() 加热分解的产物
加热分解的产物
![]() 工业废料
工业废料![]() 中含有
中含有![]() ,为了测定
,为了测定![]() 和
和![]() 的质量比x:y,实验小组利用如下图所示的装置
的质量比x:y,实验小组利用如下图所示的装置![]() 夹持仪器省略
夹持仪器省略![]() 进行实验:
进行实验:
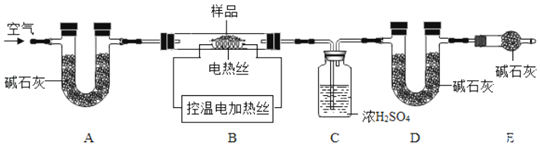
(资料三)碱石灰为固体氢氧化钠和氧化钙的混合物。可吸收水蒸气或二氧化碳。
![]() 实验前首先要______,再装入样品。装置A的作用是______。
实验前首先要______,再装入样品。装置A的作用是______。
![]() 已知
已知![]() 在
在![]() 生成
生成![]() ,
,![]() 时
时![]() 开始分解;
开始分解;![]() 在
在![]() 时分解完全。现控制B装置温度
时分解完全。现控制B装置温度![]() 进行实验并采集了如下数据:
进行实验并采集了如下数据:
![]() 反应前玻璃管与样品的质量m1g
反应前玻璃管与样品的质量m1g![]() 反应后玻璃管中固体的质量为m2g
反应后玻璃管中固体的质量为m2g
![]() 装置C实验后增重m3g
装置C实验后增重m3g![]() 装置D实验后增重m4g
装置D实验后增重m4g
某同学选用c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
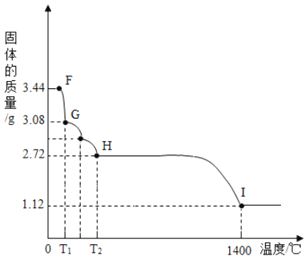
![]() 受热会逐步失去结晶水。
受热会逐步失去结晶水。
取纯净![]() 固体
固体![]() ,放在
,放在![]() 的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。
的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。![]() 点固体的化学式是______。请写出计算过程。
点固体的化学式是______。请写出计算过程。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸在工业上有着重要的用途。以黄铁矿(主要成分为FeS2)为原料生产硫酸的原理及工艺流程可简示如下:FeS2![]() SO2
SO2![]()
![]() H2SO4
H2SO4
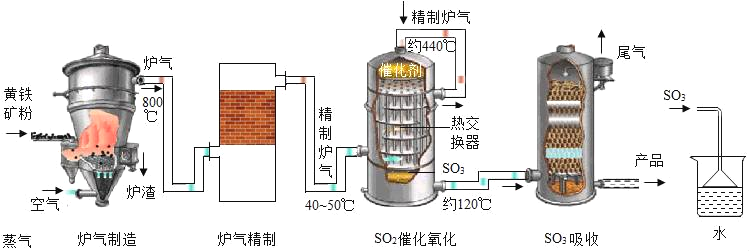
(1)工业生产过程中将矿石粉碎以及在吸收装置中液体由上而下形成喷雾状的目的是_____。
(2)在实验室模拟制硫酸时用如图装置吸收三氧化硫,除了达到与工业上相同的目的外,还可能考虑的因素是_____。
(3)工业上常用熟石灰来吸收尾气中的二氧化硫,请写出反应的化学方程式_____。(提示:生成物有一种是CaSO3)
(4)实验室中常用浓硫酸来配制稀硫酸。稀释时,正确操作是,_____,并用玻璃棒不断搅拌。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com