我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看成Ca2+,并将其折算成CaO的质量.通常把1L水中含有10 mgCaO称为1度,1L水中含有20 mgCaO即为2度;依此类推.8度以上为硬水,8度以下为软水.
(1)自然界的水中都溶有一定量的Ca(HCO3)2和Mg(HCO3)2,它们在受热时分别分解成CaCO3和Mg(OH)2,这两种白色固体在容器内壁上积淀,即形成水垢.请用化学方程式表示锅炉或水壶里水垢的形成过程.
(2)在日常生活中,如何用简便的方法确定某水样是硬水还是软水(写出主要操作、现象、结论)?
(3)取某水样10mL,经实验测定,其中含Ca2+0.001g,含Mg2+0.00048g,试通过计算回答:该水样从硬度角度看,是否符合饮用水标准?
【答案】
分析:(1)由题目所给信息可推测化学反应方程式;
(2)肥皂水可以用来鉴别硬水和软水;
(3)根据钙离子的质量可以计算出水样的硬度.
解答:解:(1)通过质量守恒定律可推测出反应方程式:Ca(HCO
3)
2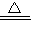
CaCO
3↓+H
2O+CO
2↑; Mg(HCO
3)
2
Mg(OH)
2↓+2CO
2↑;
(2)日常生活中,常采取向水样中加入肥皂水,取等体积的样品,都加入相同量的肥皂水,一起振荡,产生的泡沫较少、浮渣较多的是硬水,否则为软水;
(3)10mL水中,含Ca
2+0.001g,含Mg
2+0.00048g
则1L水中含Ca
2+100mg,Mg
2+48mg.将Mg
2+48mg折合成Ca
2+的质量为80mg,可看成1L水中共含Ca
2+180mg,由钙离子可求出氧化钙的质量为:
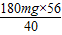
=252mg;则水样的硬度为252mg/10mL=25.2度>8度,不符合饮用水标准.
故答案为:
(1)①CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;Mg(OH)
2+2HCl=MgCl
2+2H
2O;
(2)取等体积的样品,都加入相同量的肥皂水,一起振荡,产生的泡沫较少、浮渣较多的是硬水,
(3)不符合饮用水标准.1L水样中含:Ca
2+100mg,Mg
2+48mg.折合成CaO为252mg.则水样的硬度为252mg/10mL=25.2度>8度,是硬水.(其他合理方法计算,同样得分)
点评:本题考查硬水和软水的检验、新信息处理能力及书写化学方程式的能力,解题的关键是掌握同学们对新信息的处理能力.

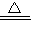 CaCO3↓+H2O+CO2↑; Mg(HCO3)2
CaCO3↓+H2O+CO2↑; Mg(HCO3)2 Mg(OH)2↓+2CO2↑;
Mg(OH)2↓+2CO2↑;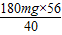 =252mg;则水样的硬度为252mg/10mL=25.2度>8度,不符合饮用水标准.
=252mg;则水样的硬度为252mg/10mL=25.2度>8度,不符合饮用水标准.

 阅读快车系列答案
阅读快车系列答案