(2012?河东区一模)为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25,0g样品,溶于水得到100g溶液,再加入100g足量稀硫酸,充分反应至不再产生气体,测得溶液质量为197.8g.
请计算:
(1)反应产生CO2的质量.
(2)样品中NaOH的质量分数.
(3)最后所得溶液中钠元素的质量.
【答案】
分析:(1)根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;
(2)样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得二氧化碳的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数;
(3)根据NaOH的质量、碳酸钠的质量分别乘以它们的质量分数可求得钠元素的质量;
解答:解:(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量为100 g+100 g-197.8 g=2.2g.
(2)解:设所取样品中含有Na
2CO
3的质量为x.
Na
2CO
3+H
2SO
4═Na
2SO
4+H
2O+CO
2↑
106 44
x 2.2g
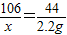
解之得:x═5.3g
烧碱样品中NaOH的质量为:25g-5.3 g=19.7 g
样品中NaOH的质量分数为:
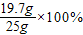
=78.8%
(3)所得溶液中钠元素的质量=
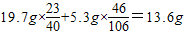
故答案为:反应产生的CO
2的质量为2.2g;样品中NaOH的质量分数为78.8%;最后所得溶液中钠元素的质量为13.6g.
点评:此题主要是在碱的化学性质的基础上考查有关质量守恒定律的有关知识,以及混合物中质量分数的计算问题,注重学生综合能力的培养,是中考的考点之一.

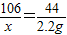
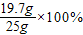 =78.8%
=78.8%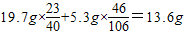


 阅读快车系列答案
阅读快车系列答案 (2012?河东区一模)青少年正处在生长发育期,应注意营养均衡,膳食合理.
(2012?河东区一模)青少年正处在生长发育期,应注意营养均衡,膳食合理. (2012?河东区一模)试剂瓶中有1000g氯化钠溶液,瓶上的标签如图所示,计算其所含溶质的质量是
(2012?河东区一模)试剂瓶中有1000g氯化钠溶液,瓶上的标签如图所示,计算其所含溶质的质量是