
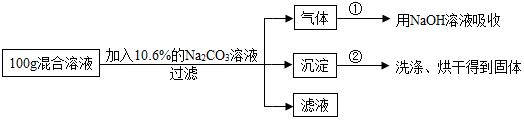
分析 (1)根据二氧化碳与氢氧化钠的反应写出反应的化学方程式;
(2)由题意可以知碳酸钠与氯化钙反应生成了碳酸钙沉淀和氯化钠,根据沉淀的质量可求出氯化钙、碳酸钠、氯化钠的质量,据此可计算出混合溶液中CaCl2的质量分数;
(3)根据图中数据可以知道生成二氧化碳的质量为4.4g,结合碳酸钠和盐酸反应的化学方程式可以求出碳酸钠的质量、氯化钠的质量,再根据溶质质量分数的计算公式计算出混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数.
解答 【解答】解:(1)根据题意可知,混合液中的稀盐酸与碳酸钠反应生成的二氧化碳气体与氢氧化钠反应生成了碳酸钠和水,反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O.
(2)设混合溶液中CaCl2的质量为x、生成的氯化钠的质量为y,与氯化钙反应的碳酸钠的质量为z
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106 100 117
x z 10g y
$\frac{111}{x}=\frac{106}{z}=\frac{100}{10g}=\frac{117}{y}$
解得:x=11.1g y=11.7g z=10.6g
∴混合溶液中CaCl2的质量分数为:$\frac{11.1g}{100g}$×100%=11.1%;
(3)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g,
设与盐酸反应的碳酸钠的质量为m,生成的氯化钠的质量为n
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
m n 4.4g
$\frac{117}{44}=\frac{z}{4.4g}$ 解得m=10.6g n=11.7g
反应的碳酸钠的质量为:$\frac{10.6g+10.6g}{10.6%}$=200g
经过滤后所得滤液中溶质的质量分数为:$\frac{11.7g+11.7g}{100g+200g-10g-4.4g}×100%$≈8.2%
故答案为:(1)CO2+2NaOH═Na2CO3+H2O;(2)(2)混合溶液中CaCl2的质量分数为11.1%;(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数为8.2%
点评 要解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合反应流程,物质间反应的方程式,按照题目要求进行认真地解答即可.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:初中化学 来源: 题型:选择题
| A. | 生成的两种物质都属于单质 | B. | 生成物的分子个数比为1:1 | ||
| C. | 反应前后元素的化合价不变 | D. | 该反应不属于基本反应类型 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
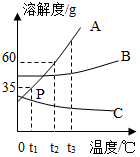 A、B、C三种物质的溶解度曲线如图所示,请回答:
A、B、C三种物质的溶解度曲线如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
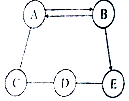 A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去),请回答下列问题:
A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去),请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
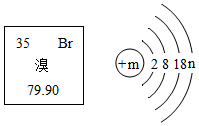 溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )
溴元素在元素周期表中的信息与溴原子结构示意图如图所示,下列说法正确的是( )| A. | 溴相对原子质量为79.90g | |
| B. | 溴原子质量由构成其原子的质子和电子决定 | |
| C. | 溴元素属于金属元素 | |
| D. | m=35、n=7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、Na2CO3、NaCl | B. | KNO3、NaCl、FeCl2 | ||
| C. | HCl、NaOH、NaCl | D. | Na2CO3、Ca(OH)2、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com