
| A. | 第一次反应停止,B剩余9g | B. | 第二次反应后,C剩余5g | ||
| C. | 反应中B和C的质量比是3:2 | D. | 反应中A和C的质量比为5:3 |
分析 若增加10gA,则反应停止后原反应物中只余C,说明此时反应掉的A为25g,B为15g.而在加入10gA前,A15g完全反应生成了30g的D.可以推知当25gA完全反应时生成的D为50g(为反应物A的质量的2倍).所以可以推知当25gA和15gB反应时消耗的C的质量为50g-25g-15g=10g.
解答 由题意,若增加10gA,则反应停止后原反应物中只余C,说明参加第二次反应的A的质量为25克,B的质量为15克,A与B参加反应的质量比为5:3;
A、B、C三种物质各15g,它们化合时只能生成30g新物质D,说明参加第一次反应的A的质量为15克,B的质量为9克,根据质量守恒定律可知参加第一次反应的C的质量为6克,则A、B、C参加反应的质量比为5:3:2,则第二次参加反应的C的质量为10克.
A、参加第一次反应的B的质量为9克,剩余6克.故错误;
B、第二次参加反应的C的质量为10克,故第二次反应后C剩余5克,故正确;
C、反应中B与C的质量比为3:2,故正确.
D、反应中A与C的质量比为5:2,故错误;
故选:BC.
点评 质量守恒定律的应用是中考考查的重点,本题考查的是灵活运用质量守恒定律的思想处理问题的能力.


科目:初中化学 来源: 题型:实验探究题
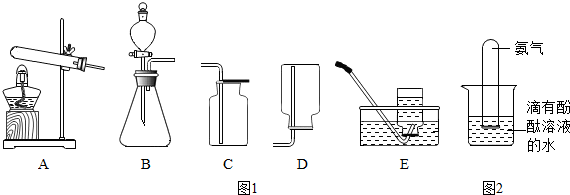
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 荔枝的部分营养成分(100克中含) |
| 糖类16.60g 蛋白质0.90g 脂肪0.20g 维生素A 2.00ug 维生素C 41.00ug 钙 2.00mg 鉀 151.00mg 铁 0.40mg 硒 0.14ug… |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
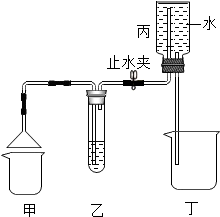 下列是初中常见物质,由下表中元素组成.
下列是初中常见物质,由下表中元素组成.| 元素名称 | 氢 | 碳 | 氧 | 氯 | 钠 | 铁 |
| 元素符号 | H | C | O | Cl | Na | Fe |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 去油污的方法有三种:用汽油擦洗、用洗涤剂清洗、用热的碳酸钠溶液洗涤 | |
| B. | 人体主要提供热能的营养素有三种:蛋白质、维生素、糖类 | |
| C. | 我国古代流传至今的三大杰出化学工艺:造纸、制火药、烧瓷器 | |
| D. | 氢能源广泛推广有三大障碍:制取成本高、易泄漏贮存难、不安全 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
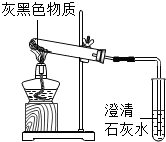 金属镁将成为二十一世纪大有前途的绿色金属材料.
金属镁将成为二十一世纪大有前途的绿色金属材料.| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 0 | 10 | 20 | 30 | |
| 溶 解 度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 |
| KNO3 | 13.3 | 20..9 | 31.6 | 45.8 | |
| Ca(OH)2 | 0.185 | 0.176 | 0.165 | 0.153 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com