
分析 (1)根据缓慢氧化的特点分析即可;
(2)根据题意,酒精(C2H5OH)在酶的作用下与空气中的氧气作用,生成了醋(CH3COOH)和水,写出反应的化学方程式即可;根据检验醋酸的方法进行分析.
解答 解:(1)食物变质是一种缓慢氧化反应,且反应中会放热;
(2)酒精(C2H5OH)在酶的作用下与空气中的氧气作用,生成了醋(CH3COOH)和水,反应的化学方程式为:C2H5OH+O2$\frac{\underline{\;酶\;}}{\;}$CH3COOH+H2O;取少量米酒滴加紫色石蕊试液,溶液变红,可确定生成了醋酸.
故答案为:(1)缓慢; 放热;(2)C2H5OH+O2$\frac{\underline{\;酶\;}}{\;}$CH3COOH+H2O;取少量米酒滴加紫色石蕊试液,溶液变红.
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.


科目:初中化学 来源: 题型:实验探究题
 老师在第十单元课题2“酸和碱的中和反应”课堂演示了酸碱中和滴定实验,但对实验进行了改进,并对两个问题进行了讨论.
老师在第十单元课题2“酸和碱的中和反应”课堂演示了酸碱中和滴定实验,但对实验进行了改进,并对两个问题进行了讨论.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 16 | B. | 27 | C. | 44 | D. | 56 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
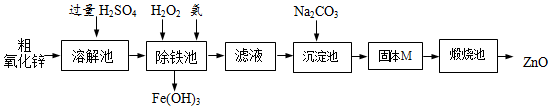
| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | 杂 质 | 除杂所用试剂和方法 | |
| A | CO2 | HCl | 先通入氢氧化钠溶液,后通过浓硫酸 |
| B | Na2CO3溶液 | Na2SO4 | 加入适量的Ba(NO3)2溶液,过滤 |
| C | Fe | Fe2O3 | 加入过量的稀盐酸,过滤 |
| D | FeCl2溶液 | CuCl2 | 加入过量的铁粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭在氧气中剧烈燃烧,发出白光,产生使澄清石灰水变浑浊的气体 | |
| B. | 硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的气体 | |
| C. | 铁丝在氧气中燃烧时,火星四射,生成黑色固体 | |
| D. | 白磷在空气中燃烧,产生大量的白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com