
【题目】甲、乙两种物质的溶解度曲线如图所示,请回答下列问题。
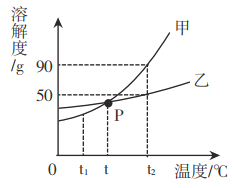
(1)t2℃时,乙物质溶解度是________________g。
(2)P点的意义是________________。
(3)t2℃时,将30g甲物质和乙物质分别加入到50g水中充分溶解,形成饱和溶液的是_____________(填“甲”或“乙”)。
(4)若甲物质中含有少量的乙物质,要提纯甲物质应进行________________(填“降温结晶”或“蒸发结晶”)。
(5)分别将甲、乙两种物质的等质量的饱和溶液从t2℃降温至t1℃,所得溶液的溶质质量分数:甲___乙(填“>”或“<”或“=”)。
【答案】50 t℃时,甲、乙两物质溶解度相同 乙 降温结晶 =
【解析】
(1)由乙物质的溶解度曲线可知,t2℃时,乙物质溶解度是50g。
(2)图中P点是甲物质和乙物质溶解度曲线的交点,表示在该温度时甲和乙的溶解度相等,则P点的意义是t℃时,甲、乙两物质溶解度相同。
(3)t2℃时,甲物质的溶解度是90g,乙物质的溶解度是50g,该温度下形成饱和溶液,50g水中所能溶解的甲和乙的质量分别为45g、25g,则将30g甲物质和乙物质分别加入到50g水中充分溶解,形成饱和溶液的是乙。
(4)由溶解度曲线图可知,甲和乙的溶解度都随着温度的升高而增大,甲物质的溶解度比乙物质溶解度受温度影响大,若甲物质中含有少量的乙物质,要提纯甲物质应进行降温结晶。
(5)如图所示,甲物质和乙物质的溶解度都随温度的升高而增大,将等质量的甲和乙的饱和溶液中从t2℃降温至t1℃,两种物质均为饱和溶液,且t1℃,两种物质的溶解度相同,故所得溶液的溶质质量分数甲=乙。


科目:初中化学 来源: 题型:
【题目】用化学用语填空:
(1) 2个镁原子__________。
(2)铁离子___________。
(3)水中氧元素显-2价__________。
(4)铵根离子________。
(5)2个碳酸分子_______。
(6)光合作用得到的单质是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐在生产生活中具有广泛的用途。化学实验室中有失去标签的四瓶无色溶液:稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液,现将其任意编号为A、B、C、D.然后两两组合进行实验,其中部分现象如下表,请回答:
实验 | A+B | A+C | B+C | B+D |
现象 | 溶液变红 | 溶液变红 | 产生沉淀 | 产生气体 |
(1)配酞试液是____________(填编号);
(2)B与C反应的化学方程式为____________________。
(3)写出D的一种用途:____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与人类密切相关,我们身边到处都是化学物质。
(1)饮用硬度过大的水不利于人体健康,生活中常用___________来鉴别硬水软水。
(2)生活中,通常选择铜丝作为导线,是利用其____________性。
(3)实验室比较锌和银的金属活动性强弱,用化学方程式表示:_____________________________。
(4)化学为人类发展作出了巨大贡献,但也带来了污染,请你写出一种生活中防止污染的做法:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映实验过程中相应量变化的是
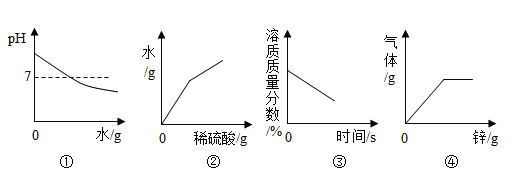
A.图①:向氢氧化钠溶液中加水
B.图②:向氢氧化钡溶液中加足量稀硫酸
C.图③:将接近饱和的硝酸钾溶液缓慢降温
D.图④:向一定量的稀硫酸中加入过量的锌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体和硫酸亚铁。试回答:
(l)实验室制取硫化氢的化学反应方程式为:_____。
(2)根据装置图回答下列问题:
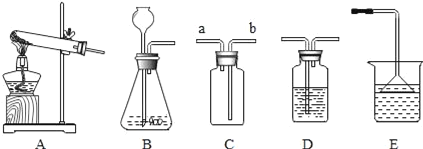
①制取硫化氢气体的发生装置可以选用_____。
②若用C装置收集硫化氢气体,进气口应为_____。
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是_____,现象是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图1是新教材化学书的封面,该图片蕴含许多化学知识,试回答:
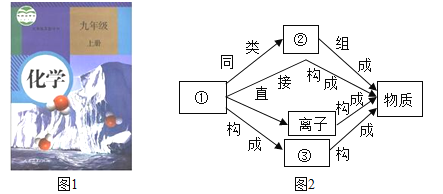
(1)图1中物质的变化是_______变化(填“物理”或“化学”)它反映出的环境问题是________,解决这种环境问题的方法是___________(答一点)。
(2)人类对物质的宏观和微观认识有图2关系,图中化学名词②是_______;若将(图2)中“物质”改成(图1)中的“液体”,并要求按照:
![]()
进行描述,则相应的语言应是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学小组同学在课外读物中看到:“加热时,过氧化钠(Na2O2)能与木炭发生化学反应”。他们决定探究Na2O2与木炭反应的产物。
(猜想与假设)木炭与Na2O2反应可能生成4种物质:CO、CO2、Na2O和Na2CO3。
(查阅资料)
① 碱性的碳酸钠溶液与中性的CaCl2溶液能发生复分解反应。
② 氧化钠(Na2O)是白色固体,与H2O反应生成NaOH。
③ 氯化钯(PdCl2)溶液能检验CO的存在,向溶液中通入CO,产生黑色沉淀。
(进行实验)同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)。
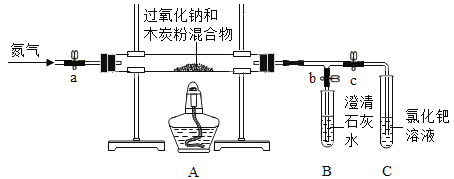
序号 | 实验操作 | 主要实验现象 | 实验结论 |
① | 检查装置气密性。向玻璃管中加入过氧化钠和过量木炭粉的混合物。打开弹簧夹a、b,关闭c,从装置左端通一段时间N2。 | A中无明显变化,B中有大量气泡冒出。 | 气密性良好。 |
② | 关闭a,点燃酒精灯。 | 试管中发生剧烈反应,产生火花,________________。 | 产物中没有CO2。 |
③ | 打开c,关闭b。 | C中PdCl2溶液没有明显变化。 | ___________________。 |
④ | 打开a,继续通N2,停止加热,待冷却后停止通N2。取出少量反应后固体于试管中,加入足量稀盐酸,迅速用带导管的橡胶塞塞紧试管口,导管另一端通入石灰水中。 | _____________________。 | 产物中有Na2CO3。 |
(解释与结论)
(1)检验第4种物质存在的实验方案:取出少量反应后固体于试管中,_______________,则第4种物质存在。
(2)Na2O2与木炭反应的化学方程式为_________________________________。
(反思与评价)实验操作④中若不通入N2,可能造成的结果是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.
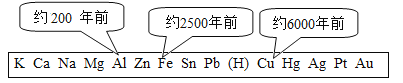
(1)上图表示金属活动性顺序中铝、铁和铜被人类大规模开发利用的大致年限,根据图中数据和相关化学知识,你认为金属大规模开发利用的先后顺序与下列因素无关_____
A 金属冶炼的难易程度
B 地壳中金属元素的含量
C 金属的活动性
(2)请用一个化学方程式说明铁的金属活动性比铜强_____.
(3)工业上电解氧化铝制取金属铝的化学方程式是:2Al2O3![]() 4Al+3O2↑,电解51t的氧化铝最多可生产多少吨铝?
4Al+3O2↑,电解51t的氧化铝最多可生产多少吨铝?
(4)实际生产中氧化铝可从铝土矿提炼获得.要生产相同质量的铝,所需铝土矿的质量应_(填“大于”、“小于”或“等于”)氧化铝质量_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com