
 碘元素是人体必需的微量元素之一.
碘元素是人体必需的微量元素之一. ×100% 则y=15÷(
×100% 则y=15÷( ×100%)=25.3;
×100%)=25.3; ×100%)(或15÷(
×100%)(或15÷(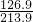 ×100%)或约25.3 ).
×100%)或约25.3 ).

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:初中化学 来源:化学教研室 题型:013
A.人体必需的微量元素有20多种
B.我们可以通过喝加钙牛奶补充微量元素Ca
C.人体缺少微量元素就会生病,因此我们要尽可能的多吃含有这些元素的营养补剂
D.缺少微量元素碘,会导致贫血
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com