
分析 根据盐的概念:盐是含有金属离子和酸根离子组成的一类化合物进行分析;
根据化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零进行分析.
解答 解:化学上所说的盐是指含有金属离子和酸根离子组成的一类化合物;
氯化钠中,钠离子显示+1价,氯离子显示-1价,化学式为:NaCl;
碳酸钾中,钾离子显示+1价,碳酸根离子显示-2价,化学式为:K2CO3;
硫酸铜中,铜离子显示+2价,硫酸根离子显示-2价,化学式为:CuSO4;
碳酸钙中,钙元素显+2价,碳酸根离子显-2价,化学式为:CaCO3;
硝酸钡中,钡离子显示+2价,硝酸根离子显示-1价,化学式为:Ba(NO3)2;
硝酸银中,银离子显示+1价,硝酸根离子显示-1价,化学式为:AgNO3;
碳酸铵中,铵根离子显示+1价,碳酸根离子显示-2价,化学式为:(NH3)2CO3;
氯化铁中,铁元素显示+3价,氯元素显示-1价,化学式为:FeCl3;
碳酸钡中,钡离子显示+2价,碳酸根离子显示-2价,化学式为:BaCO3;
氯化亚铁中,铁元素显示+2价,氯元素显示-1价,化学式为:FeCl2;
硫酸亚铁中,铁元素显+2价,硫酸根离子显-2价,化学式为:FeSO4.
故答案为:含有金属离子和酸根离子组成的一类化合物;
NaCl;
K2CO3;
CuSO4;
CaCO3;
Ba(NO3)2;
AgNO3;
(NH3)2CO3;
FeCl3;
BaCO3;
FeCl2;
FeSO4.
点评 本题难度不大,掌握盐的概念与特征(含有金属离子和酸根离子)、盐与食盐的关系并能灵活运用是正确解答本题的关键.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
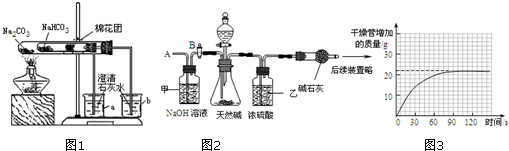
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取天然碱样品少量溶于足量水后,加入过量的CaCl2稀溶液(如果操作一有沉淀,则进行操作二) | 无沉淀出现 | 假设一成立 |
| 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的Ca(OH)2溶液,观察 | 无沉淀出现 | 假设二成立 |
| 产生白色沉淀 | 假设三成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com