

| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
分析 根据硫酸铜在溶液中显蓝色,硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡生成溶于酸的碳酸钡沉淀,氢氧化钠、碳酸钠的水溶液显碱性等知识进行分析.
解答 解:硫酸铜在溶液中显蓝色,硫酸钠和氯化钡生成不溶于酸的硫酸钡沉淀,碳酸钠和氯化钡生成溶于酸的碳酸钡沉淀,氢氧化钠、碳酸钠的水溶液显碱性.
(1)白色粉末加水溶解得到无色溶液和白色沉淀,所以粉末中一定不含硫酸铜,白色沉淀加入稀盐酸,全部溶解,所以白色粉末中一定含有氯化钡、碳酸钠,一定不含硫酸钠,可能含有氢氧化钠;
(2)生成白色沉淀的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(3)碳酸钠、氢氧化钠都显碱性,都能使无色酚酞变红色,要检验氢氧化钠需要先将碳酸钠检验并除去,所以
| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | HCl CuCl2 NaNO3 Na2SO4 | B. | BaCl2 Na2CO3 HCl (NH4)2CO3 | ||
| C. | FeCl3 HCl NaCl NaOH | D. | Na2CO3 Na2SO4 HCl H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
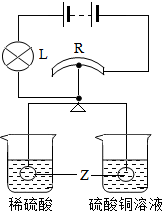 如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将锌球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到:
如图所示,R是滑动变阻器,它的金属滑片垂直固定在等臂金属杠杆的中央且可以随杠杆左右移动.杠杆两端分别悬挂等质量、等体积的金属锌球,此时杠杆平衡.再将锌球同时分别浸没到密度相同的稀硫酸和硫酸铜溶液中.反应一段时间后会观察到:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 今年我国纪念“世界水日”和“中国水周”活动的宣传主题为“节约水资源,保障水安全”.
今年我国纪念“世界水日”和“中国水周”活动的宣传主题为“节约水资源,保障水安全”.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
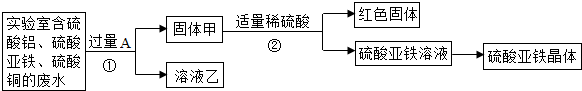

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
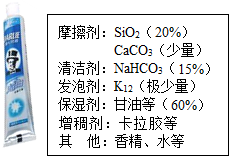 牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 试验后(g) | 0.43 | 0.44 | 0.45 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com