
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
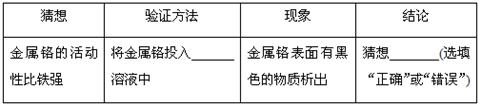
科目:初中化学 来源: 题型:阅读理解
| OH- | NO3- | SO42- | Cl- | CO32- | |
| Cr3+ | 不 | 溶 | 溶 | 溶 | - |
| 金属 | Cr | Al | Cu |
| 与盐酸反应的现象 | 气体产生缓慢 金属逐渐溶解 |
气泡产生激烈 金属迅速溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现象 | 气泡产生缓慢,金 属逐渐溶解 |
气泡产生激烈,金 属迅速溶解 |
无气泡产生,金属 无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com