
氢氧化钠与盐酸发生中和反应的化学方程式为______.
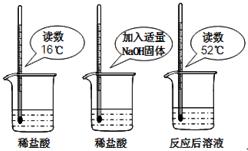
(1)为证明中和反应是放热反应,某小组进行了如如图所示的实验操作:根据如图实验,甲同学认为:NaOH与稀盐酸发生的中和反应是放热反应.乙同学认为:甲同学得出这个结论的依据不科学,理由是______.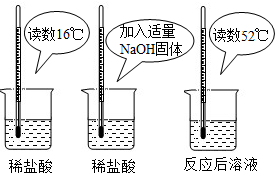
(2)为探究影响中和反应放出热量多少的因素,他们又进行了如下实验:在编号为A、B、C、D、E的五只烧杯中各装入36.5g 溶质质量分数为5%、10%、15%、20%、25%的盐酸,再向上述五只烧杯中分别加入40g20% 的氢氧化钠溶液,最后测量其温度,数据记录如下:
| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
【实验结论】影响中和反应放出热量多少的因素是______.
【交流反思】反应后,烧杯内溶液pH最小的是______(填烧杯编号).


科目:初中化学 来源: 题型:
 27、氢氧化钠与盐酸发生中和反应的化学方程式为
27、氢氧化钠与盐酸发生中和反应的化学方程式为| 烧杯编号 | A | B | C | D | E |
| 盐酸的溶质质量分数 | 5% | 10% | 15% | 20% | 25% |
| 反应后溶液温度(℃) | 24℃ | 34℃ | 46℃ | 54℃ | 54℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
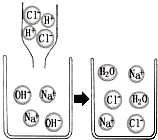 如图是氢氧化钠与盐酸发生复分解反应的微观粒子示意图,同时我们已知道复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.结合信息、图示,你认为下列各组离子间不能反应的是( )
如图是氢氧化钠与盐酸发生复分解反应的微观粒子示意图,同时我们已知道复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.结合信息、图示,你认为下列各组离子间不能反应的是( )查看答案和解析>>
科目:初中化学 来源: 题型:
| 同学 | 实验操作 | 现象 | 结论 |
| 甲 | 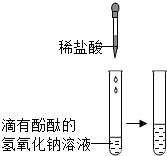 |
溶液由红色变成 无色 无色 |
氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 HCl+NaOH=NaCl+H2O HCl+NaOH=NaCl+H2O |
| 乙 | 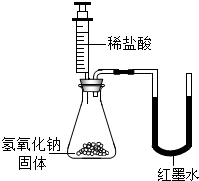 |
U型玻璃管中 左 左 边的红墨水液面下降(所加稀盐酸的体积忽略不计) |
氢氧化钠与盐酸发生了化学反应 |
| 丙 | 用 pH试纸 pH试纸 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH |
最后溶液的pH ≤7 ≤7 (填“≥7”、“≤7”、“不变” |
氢氧化钠与盐酸发生了化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com