
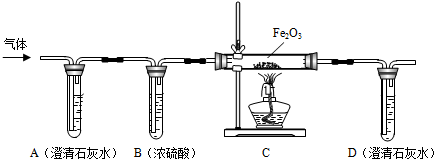
分析 [实验探究](1)根据溶液的酸碱度测定方法进行分析;
(2)根据水的组成分析蚁酸中含有的元素;
(3)①根据蚁酸的组成元素分析生成气体;
②二氧化碳能使澄清的石灰水变浑浊,考虑一氧化碳的可燃性,据此分析判断;
③根据浓硫酸具有吸水性分析装置B的作用;
④根据在加热的条件下一氧化碳与氧化铁反应生成了二氧化碳和铁,分析实验时装置C中的现象;
⑤根据二氧化碳与氢氧化钙的反应写出反应的方程式,
[反思评价]①根据一氧化碳有毒能污染空气分析处理尾气的方法;
②根据二氧化碳的性质进行分析.
解答 解:[实验探究]
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成红色,说明蚁酸溶液显酸性;
(2)根据蚁酸中含有H、O元素,推测出一种生成物是水;
(3)①由于蚁酸中含有碳、氢、氧三种元素,蚁酸在隔绝空气并加热的条件下会分解生成两种氧化物,一种生成物是水,另一种生成的氧化物是气体,所以小敏提出的猜想Ⅱ:该气体是CO;
②由于二氧化碳能使澄清的石灰水变浑浊,实验时装置A中无明显变化,证明不是二氧化碳气体,则猜想Ⅰ不成立,若猜想Ⅱ成立,刚开始通入一会气体的目的是排净试管中的空气,防止加热时发生爆炸;
③由于浓硫酸具有吸水性,实验时装置B的作用是:干燥CO气体;
④在加热的条件下一氧化碳与氧化铁反应生成了二氧化碳和铁,实验时装置C中的现象是:红色粉末逐渐变黑;
⑤实验时装置D中发生反应是二氧化碳与氢氧化钙发生了反应,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
[反思评价]
①由于一氧化碳有毒能污染空气,从环保角度看,该装置存在明显的缺陷是缺少尾气处理,处理方法是:在尾部放一个燃着的酒精灯;
②小明经过思考后发现从蚁酸的化学式即可确定出蚁酸分解的两种氧化物中一定不含二氧化碳,他的依据实验时装置A中无明显变化.
故答案为:
[实验探究](1)红;(2)H、O;
(3)①CO;②不成立;排净试管中的空气,防止加热时发生爆炸;③干燥CO气体;④红色粉末逐渐变黑;⑤CO2+Ca(OH)2═CaCO3↓+H2O;
[反思评价]①在尾部放一个燃着的酒精灯;②实验时装置A中无明显变化.
点评 本题属于信息题的考察,考查了质量守恒定律的运用、一氧化碳、二氧化碳的化学性质等知识点,解答本题的关键是要充分理解实验装置的特点和各种物质的性质,只有这样才能对问题做出正确的判断.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
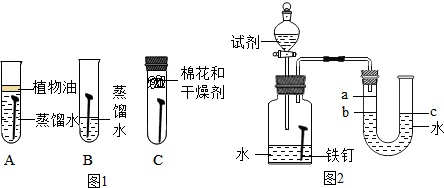
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置Ⅰ放入25℃恒温环境中,装置Ⅱ放入40℃恒温环境中 | 两套装置中铁钉均锈蚀,且U形管中液面均由b处上升至a处,则所需时间Ⅰ>Ⅱ | 锈蚀的速率Ⅰ<Ⅱ;铁的锈蚀速率与反应时的温度有关温度越高,铁的锈蚀速度越快 |
| ②氧气含量 | 在相同温度下,装置Ⅰ集气瓶中加入氧气加入10mL乙醇 | 两套装置中铁钉均锈蚀,且U形管中液面均由b处上升至a处,则所需时间Ⅰ>Ⅱ | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快 |
| ③水溶液的导电性 | 在相同温度下,装置Ⅰ集气瓶中加入10mL氯化钠溶液;装置Ⅱ集气瓶中加入10mL乙醇 | 两套装置中铁钉均锈蚀;且U形管中液面均由b处上升至a处,则所需时间Ⅰ<Ⅱ | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| SO2最高质量分数限值(单位:mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com