

| 工业纯碱标准:(Na2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
分析 (1)根据除去硫酸根离子用钡离子沉淀,除去镁离子用氢氧根离子进行沉淀,除去钙离子用碳酸根离子进行沉淀,过量的钡离子需要用碳酸根离子除去进行分析,再向滤液中加入适量的盐酸得到精盐水进行分析;
(2)根据碳酸钠和氯化钡反应会生成碳酸钡沉淀和氯化钠,和氯化钙反应会生成碳酸钙沉淀和氯化钠进行分析;
(3)根据碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析;
(4)根据氨碱法制纯碱的原理进行分析;
(5)根据确定纯碱样品含有的杂质,可用反向思维方法,先确定白色沉淀,再推断杂质是什么进行分析;
(6)利用质量守恒定律计算出二氧化碳的质量,再根据化学方程式计算出碳酸钠的质量分数,确定其等级;
(7)根据盐酸具有挥发性分析回答.
解答 解:(1)A、一定温度下,氯化钠的溶解度是固定不变的,不会因搅拌就改变其溶解度,只会加快氯化钠的溶解速度;故A错误;
B、③④两步颠倒不会影响除掉钡离子和镁离子而形成沉淀;故B正确;
C、加入过量的氯化钡溶液,可以将硫酸根离子转化为沉淀,加过量碳酸钠溶液,可以将钙离子和反应剩余的钡离子转化为沉淀,加过量氢氧化钠溶液,可以将镁离子转化为沉淀,所以⑤操作中得到的沉淀共有四种;故C错误;
D、⑥操作中,加入适量盐酸的目的是除去过量的氢氧化钠和碳酸钠从而得到氯化钠溶液呈中性;故D正确.
故选:AC;
(2)碳酸钠和氯化钡反应会生成碳酸钡沉淀和氯化钠,和氯化钙反应会生成碳酸钙沉淀和氯化钠,所以加入碳酸钠溶液的目的是:除去氯化钙和过量的氯化钡;
(3)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)根据氨碱法制纯碱的原理:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 副产物为:NH4Cl;
(5)由题意可知,滴加AgNO3溶液,有白色沉淀,此沉淀即AgCl,所以反应物中一定有氯离子,并且样品完全溶于水,由此可以推断纯碱样品含有杂质NaCl;
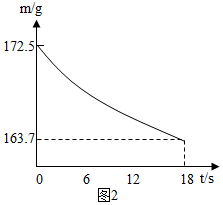
(6)从坐标读出烧杯总质量的变化为:172.5-163.7=8.8g 是生成二氧化碳的质量.
设产生8.8克二氧化碳需碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
$\frac{106}{x}$=$\frac{44}{8.8g}$
x=21.2g
Na2CO3%=$\frac{21.2g}{21.5g}$×100%=98.6%
因:98.0%<98.6%<98.8%
所以此样品为合格品;
(7)稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大(或水蒸气随CO2气体排出,从而导致所测纯度偏大).
故答案为:(1)AC;
(2)除去氯化钙和过量的氯化钡;
(3)2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4):NH4Cl;
(5)NaCl;
(6)合格;
(7)稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测纯度偏大.
点评 本题难度较大,主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法进行解答,培养学生对知识的应用和理解的能力;在书写化学方程式及计算过程一定要规范.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:选择题
| A. | 分子 | B. | 原子 | C. | 离子 | D. | 元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
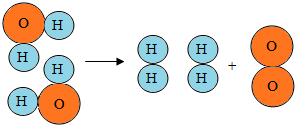
| A. | 这是一个化合反应 | |
| B. | 在化学变化中氢原子和氧原子是最小的粒子 | |
| C. | 水是由氢气和氧气组成的 | |
| D. | 在化学变化中氢分子和氧分子都没有发生变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 步骤 | 现象 | 结论 |
| 你的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com