
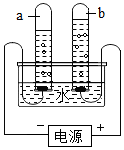
 用如图装置电解水,一段时间后的现象如图所示.对该实验的描述错误的是( )
用如图装置电解水,一段时间后的现象如图所示.对该实验的描述错误的是( )| A. | a试管中可收集到一种能燃烧的气体 | |
| B. | 该实验能证明水是由氢和氧组成 | |
| C. | b试管中收集到的是氧气 | |
| D. | a、b两试管内收集到的气体的体积比约为4:1 |
分析 电解水时,与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多,且两者的体积之比大约是1:2,据此结合题意进行分析解答.
解答 解:A、a试管与电源负极相连,试管内产生的气体体积多,气体能燃烧,故选项说法正确.
B、电解水生成氢气和氧气,氢气和氧气分别是由氢元素和氧元素组成的,说明水是由氢元素和氧元素组成的,故选项说法正确.
C、b试管与电源正极相连,试管内产生的气体体积少,是氧气,故选项说法正确.
D、电解水时,与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多,a、b两试管内收集到的气体的体积比约为2:1,故选项说法错误.
故选:D.
点评 本题难度不大,掌握电解水的实验现象、结论(正氧负氢、氢二氧一)等是正确解答本题的关键.


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水轮机带动发电机发电:电能转化为机械能 | |
| B. | 燃料燃烧:化学能转化为内能 | |
| C. | 汽油机的做功冲程:机械能转化为内能 | |
| D. | 给蓄电池充电:化学能转化为电能 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金 | B. | 铜 | C. | 铁 | D. | 无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜+氢氧化钠→硫酸钠+氢氧化铜 | |
| B. | 碳酸氢钠$\stackrel{加热}{→}$碳酸钠+二氧化碳+水 | |
| C. | 氢气+氯气$\stackrel{点燃}{→}$氯化氢 | |
| D. | 碳+氧化铜$\stackrel{高温}{→}$铜+二氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com