C
分析:根据钠与水反应生成了氢氧化钠及铝与氢氧化钠反应生成了偏铝酸钠和氢气,求出生成的氢气、偏铝酸钠的物质的量及质量,再根据溶质质量分数的公式求出溶液的溶质质量分数.
解答:由2Na+2H
2O═2NaOH+H
2↑和2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑可知,将a mol钠和a mol铝一同投入m g足量水中,共得到氢气的物质的量为2a mol,生成偏铝酸钠的物质的量为a mol.所以,所得溶质的质量为82ag,所得溶液的质量为:23ag+27ag+mg-4ag=(46a+m)g.所得溶液的溶质质量分数为:
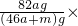
100%=
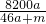
%.由以上计算可知:
A、溶液的溶质质量分数不是
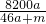
%故A错误;
B、溶液的溶质质量分数不是
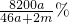
.故B错误;
C、溶液的溶质质量分数是
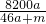
%.故C正确;
D、溶液的溶质质量分数不是
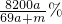
.故D错误.
故选C.
点评:解答本题的关键是根据质量守恒定律准确地求出溶液的质量.溶液的质量等于参加反应的钠、铝的质量与水的质量之和,再减去生成的氢气的质量.

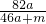 %
%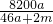 %
%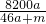 %
%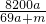 %
%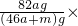 100%=
100%=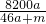 %.由以上计算可知:
%.由以上计算可知: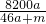 %故A错误;
%故A错误;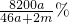 .故B错误;
.故B错误;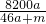 %.故C正确;
%.故C正确;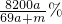 .故D错误.
.故D错误.
