
| 实验步骤 | 实验现象 | 实验结论 |
| 另取少量余下样品于两支试管中,分别滴加足量的Na CO,溶液 | 只产生白色沉淀 | 该样品为b处溶液 |
| 先产生气泡,后产生白色沉淀 | 该样品为c处溶液,并推知液中的阳离子有Ca2+、H+ |
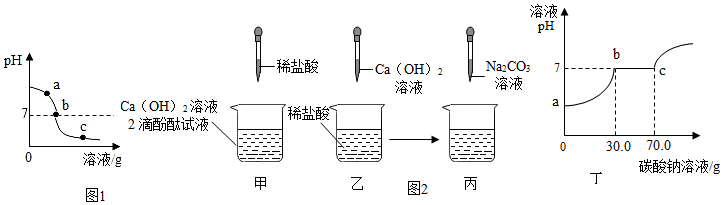
分析 (1)根据溶液的pH变化情况来分析;
(2)考虑酸碱中和生成盐和水,根据反应原理来书写;
(3)根据溶液的酸碱性以及碳酸钠的化学性质来分析.物质之间发生化学反应时,可能恰好完全反应,也可能有的反应物有剩余;合理设计实验,通过实验现象可以判断物质的组成情况.
(4)①根据盐酸和氢氧化钙的反应进行分析;
②反应后的溶液是氯化钙溶液,和碳酸钠溶液反应生成碳酸钙沉淀,根据化学反应方程式进行分析计算.
解答 解:(1)由图象可知,该溶液的pH由大到小,说明是向碱溶液中滴加酸;
(2)因为氢氧化钙与稀盐酸反应生成氯化钙和水;故其化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
(3)【探究过程】
①根据图可知:a处的溶液显碱性,加入酚酞试液,观察到其中一支试管内出现溶液由无色变成红色的现象;
②根据图可知:b处溶液为氢氧化钙与稀盐酸恰好反应,生成氯化钙中性溶液;而c处的溶液显酸性,溶液中的溶质是氯化钙和氯化氢,其中的阳离子是钙离子和氢离子,溶液显酸性,加入碳酸钠后,先与稀盐酸反应生成二氧化碳气体,当盐酸完全反应后再与氯化钙反应生成白色沉淀;
(4)①盐酸和氢氧化钙的反应生成氯化钙和水,恰好中和后,溶液中的溶质只有氯化钙;
②由图可知,碳酸钠溶液的量到70g时,反应正好完成;氯化钙和碳酸钠的反应生成碳酸钙和水,据题意,设参加反应的CaCl2的质量为x,则
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106
x 40g×26.5%
$\frac{111}{106}=\frac{x}{40g×26.5%}$
解得:x=11.1g
该CaCl2溶液的溶质质量分数为:$\frac{11.1g}{60g}$×100%≈18.5%
故答案为:
(1)稀盐酸;(2)Ca(OH)2+2HCl═CaCl2+2H2O;
(3)①溶液由无色变成红色.②
| 实验步骤 | 实验现象 | 实验结论 |
| 只产生白色沉淀 | ||
| 先产生气泡,后产生白色沉淀 | Ca2+、H+. |
点评 本题考查了碱的化学性质,学生应熟悉碱的通性,并能利用信息结合碱的性质来解决问题,(1)中反应与图象相结合,明确图象中曲线的变化是解答的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 小明同学在“××雪饼”的包装袋内发现一小包干燥剂,干燥剂袋上的部分文字见右下图.过几天后小明发现纸袋内的白色颗粒粘在一起成为块状固体M.请回答下列问题:
小明同学在“××雪饼”的包装袋内发现一小包干燥剂,干燥剂袋上的部分文字见右下图.过几天后小明发现纸袋内的白色颗粒粘在一起成为块状固体M.请回答下列问题:| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 探究一:固体M是否失效 | 取适量固体M,加入盛有水的烧杯中,用温度计测量加入前后的温度 | 温度没有明显变化 | 没有氧化钙 |
| 探究二:固体M中是否含有氢氧化钙 | 将上述烧杯内的液体充分搅拌、静置,取上层清液,加入无色酚酞试液 | 酚酞试液变红 | 有氢氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案编号 | 方案1 | 方案2 |
| 实验操作 (分别取少量实验后的溶液于试管中) | 加入少许氧化铁 | 滴加硝酸银溶液 |
| 实验现象 | 固体逐渐消失,溶液由无色变成黄色 | 产生白色沉淀. |
| 实验结论 | 猜想二成立. | |
| 第1次 | 第3次 | 第4次 | |
| 加入盐酸的质量(g) | 20 | 20 | 20 |
| 剩余固体的质量(g) | 35 | a | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验方案 | 现象与结论 |
| 观察到黑色粉末全部被磁铁吸引,说明猜想③正确. | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应前 | 反应后 | ||
| 实 验 数 据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
| 150g | 15g | 160.6g | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com