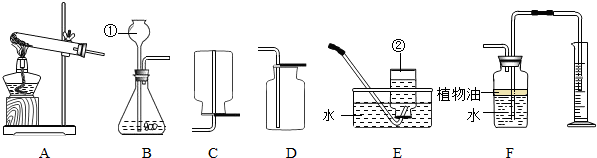
解:(1)掌握常用仪器的名称:①酒精灯②长颈漏斗.
(2)实验室制取气体是选择相关的化学反应,根据反应原理和反应条件来确定实验装置,再根据实验装置来确定实验的操作步骤和注意事项.常温下,在过氧化氢(H
2O
2)溶液中加入MnO
2(固体粉末)即可制取氧气.用这种方法制取氧气时,过氧化氢以二氧化锰为催化剂生成水和氧气,反应物的状态是固态和液态,反应条件是常温,应选固-液不加热型的发生装置,应选用的发生装置是B;氧气的密度比空气大,不易溶于水,可用向上排空气法或排水法收集,收集装置是D或E.
(3)实验室通常用石灰石和稀盐酸反应制取CO
2,该反应的化学方程式CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;此外,CO
2也要以用碳酸氢钠(NaHCO
3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为:2NaHCO
3
Na
2CO
3+H
2O+CO
2↑,若用此法来制取CO
2应选用的气体发生装置为 A,收集装置通常用 D.
(4)在这个实验中若要验证反应物NaHCO
3未完全分解,应进行的实验是(写出所用装置及操作方法),考虑碳酸氢钠加热生成二氧化碳,检验二氧化碳,从而检验碳酸氢钠,故:选置换A和F连接,加热,可能观察到的现象是 导管口有连续气泡产生,澄清石灰水变浑浊或导管口产生连续气泡,但因量少,澄清石灰水无变化
(5)用于制取CO
2的NaHCO
3样品中可能含有氯化钠,验证的方法是:利用“氯离子与银离子生成白色沉淀”,则:①取样品少许加蒸馏水溶解,然后加入过量的 稀硝酸,至无气泡产生;②在上述溶液中滴加 硝酸银溶液,可观察到的现象是 产生白色沉淀
故答为:(1)①酒精灯②长颈漏斗.
(2)B; D或E.
(3)CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑; 2NaHCO
3
Na
2CO
3+H
2O+CO
2↑,A,D.
(4)选置换A和F连接,加热,导管口有连续气泡产生,澄清石灰水变浑浊或导管口产生连续气泡,但因量少,澄清石灰水无变化
(5)稀硝酸,硝酸银,产生白色沉淀.
分析:此题考查了实验室制取气体时装置的选取和根据气体的性质选取收集装置,应根据反应物的状态、反应条件和生成气体的性质分别选择或设计气体的发生装置和收集方法.同时考查了实验室用稀盐酸和石灰石反应制取CO
2反应的化学方程式的书写,及其根据二氧化碳的性质,使实验数据更精确对其设计方案评价的一道综合题.
熟记常用的化学方程式;根据反应物的状态和反应条件确定实验室制取气体的发生装置,根据气体的密度和溶水性确定气体的收集装置,因为要收集到干燥的气体,因而应在收集装置前面加一个干燥装置;只要证明瓶口是氧气就说明氧气已收集满.检验碳酸氢钠要根据加热后的生成物二氧化碳来确认.
点评:用排水法收集到的气体纯净但湿润,用排空气法收集的气体干燥但不纯.要使用排水法收集到的气体纯净,还必须要注意两点:一、集气瓶要装满水,二、要等到气泡均匀冒出时开始收集.此题综合考查了氧气和二氧化碳的制取方法,要结合反应物的性质和生成物的性质回答问题,检验二氧化碳用澄清石灰水.


 Na2CO3+H2O+CO2↑,若用此法来制取CO2应选用的气体发生装置为 A,收集装置通常用 D.
Na2CO3+H2O+CO2↑,若用此法来制取CO2应选用的气体发生装置为 A,收集装置通常用 D. Na2CO3+H2O+CO2↑,A,D.
Na2CO3+H2O+CO2↑,A,D.

 名校课堂系列答案
名校课堂系列答案