
| A. | 滤渣中一定有Zn | B. | 滤渣中可能有Ag、Cu | ||
| C. | 滤液中-定有Fe(NO3)2、Zn(NO3)2 | D. | 滤液中可能有AgNO3、Cu(NO3)2 |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,利用此知识分析即可.
解答 解:在金属活动性顺序中,锌>铁>氢>银,在AgNO3、Zn(NO3)2的混合溶液中加人一定量的铁粉,铁能置换出硝酸银中的银,不能置换硝酸锌中的锌,充分反应后过滤,向滤渣中加入稀盐酸有气泡产生,说明加入的铁是过量的,所以滤渣中一定含有的物质是银、铁,溶液中-定有Fe(NO3)2、Zn(NO3)2.
A、由于锌的活动性大于铁,滤渣中一定没有Zn,故A错误;
B、滤渣中不可能有Cu,故B错误;
C、由上述分析可知,滤液中-定有Fe(NO3)2、Zn(NO3)2,故C正确;
D、滤液中不可能有Cu(NO3)2,故D错误.
故选C.
点评 此题考查了金属活动顺序表中锌、铁、铜、银的金属活动性强弱,及其金属活动性顺序表的应用,锻炼了学生分析问题解决问题的能力.


科目:初中化学 来源: 题型:实验探究题
| 第一组 | 第二组 | 第三组 | 第四组 | 第五组 | |
| 实验温度 | 20℃ | 20℃ | 20℃ | 20℃ | 80℃ |
| 溶质种类 | 食盐 | 食盐 | 食盐 | 硝酸钾 | 食盐 |
| 溶质状态 | 粉末 | 粉末 | 块状 | 粉末 | 粉末 |
| 溶质质量 | 3.6g | 3.6g | 3.6g | 3.6g | 3.6g |
| 溶剂种类 | 水 | 植物油 | b | 水 | 水 |
| 溶剂质量 | 10g | a | 10g | 10g | 10g |
| 溶解情况 | 固体全溶 | 固体不溶 | 固体全溶 | 固体部分溶 | 固体全溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 取反应后的滤液观察,滤液可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,可能有气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)2016年底,沪昆高铁和云贵高铁即将开通,人们的出行将更加方便、快捷.结合所学化学知识,回答下列问题:
(1)2016年底,沪昆高铁和云贵高铁即将开通,人们的出行将更加方便、快捷.结合所学化学知识,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
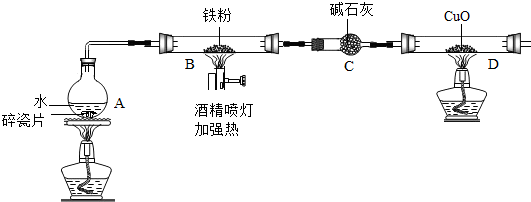
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气能被压缩--分子体积可以变小 | |
| B. | 铵盐都能与氢氧化钠反应立生氨气--铵盐中含有NH4+ | |
| C. | 结冰的水不能流动--0℃以下,水分子不再运动 | |
| D. | 20mL水和20L酒精混合后的总体积小于40mL--分子的质量和体积都很小 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
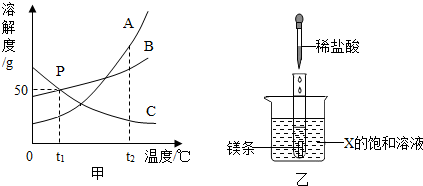
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
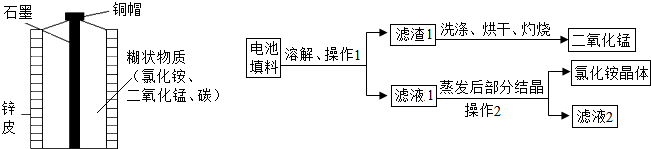
| 实验序号 | 不同纯度的锌 | 硫酸的质量分数/% | 反应温度/℃ | 锌消失的时间/s |
| Ⅰ | 含杂质锌 | 3 | 20 | 200 |
| Ⅱ | 纯锌 | 3 | 20 | 500 |
| Ⅲ | 纯锌 | 6 | 20 | 300 |
| Ⅳ | 纯锌 | 6 | 30 | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com