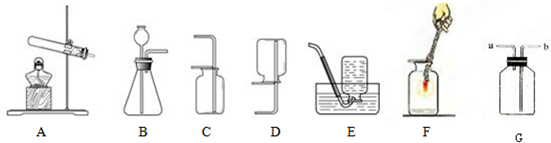
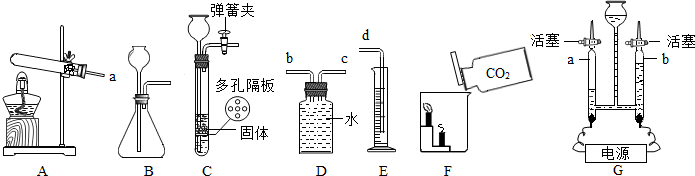
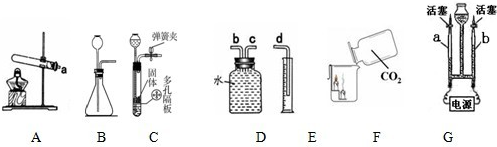
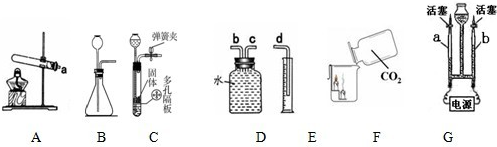
解:I.(1)实验室用大理石和稀盐酸反应制取CO
2,反应的化学方程式CaCO
3+2HCl═CaCl
2 +H
2 O+CO
2 ↑;
(2)C装置的优点是可随时控制反应的发生与停止;
(3)实验F的现象是下层的蜡烛先熄灭,上层的蜡烛后熄灭,体现二氧化碳不能燃烧,也不支持燃烧,密度比空气大;
(4)若各装置的连接顺序是:a→b→c→d,F装置内导管应c管延长,有利于排水,故如图
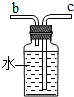
;
(5)①b玻璃管(碱式滴定管)内气体是氧气,氧气的检验方法是打开活塞,用带火星的木条放在玻璃管尖嘴口;②此探究实验的目的是探究水的组成;
Ⅱ、(1)可设生成的氧气都为32g,则有
2H
2O
2
2H
2O+O
2↑;
68 32
2KMnO
4
K
2MnO
4 +MnO
2 +O
2↑;
316 32

KClO
3

KCl+O
2↑;
81.7 32
2H
2O

2H
2↑+O
2 ↑;
36 32
2HgO

2Hg+O
2↑
433 32
比较可知生成相同质量的氧气,水用的最少,反之等质量的五种物质制氧气,完全反应后生成氧气最多的是水.
故选D;
(2)选过氧化氢,设制取6.4g氧气,消耗过氧化氢的质量为x.
2H
2O
2
2H
2O+O
2↑
68 32
x 6.4 g
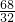
=
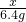
,解得x=13.6g
故答案为:
I、(1)CaCO
3+2HCl═CaCl
2 +H
2 O+CO
2 ↑;
(2)可随时控制反应的发生与停止;
(3)二氧化碳不能燃烧,也不支持燃烧,密度比空气大;
(4)
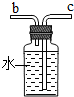
;
(5)①打开活塞,用带火星的木条放在玻璃管尖嘴口;②探究水的组成;
II、(1)D;
(2)选过氧化氢,设制取6.4g氧气,消耗过氧化氢的质量为13.6g.
分析:I.(1)根据实验室制取二氧化碳的原理分析;
(2)根据C装置的特点进行分析;
(3)根据该实验的现象分析二氧化碳的性质;
(4)根据氧气的密度比水小,通过排水量测定所收集到的氧气体积时气体应从短管进,水从长管排出;
(5)①根据氧气的性质来检验氧气;②根据电解水实验的目的是探究水的组成进行分析;
Ⅱ、(1)我们可以先计算出要得到等质量的氧气哪一种物质用的最少,则说明哪一种物质产生氧气能力最强,那么等质量的上述物质中该物质生成的氧气最多.
(2)选一种物质,根据反应的化学方程式进行分析即可.
点评:解答Ⅱ、(1)的方法是很多种的,但是最简单的方法就是我们称之为“归一法”,即假定某种物质的化学计量数为“1”,或假定每种物质各1g,写出化学方程式,便可计算比较出结果.

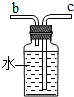 ;
; 2H2O+O2↑;
2H2O+O2↑; K2MnO4 +MnO2 +O2↑;
K2MnO4 +MnO2 +O2↑; KClO3
KClO3
 KCl+O2↑;
KCl+O2↑; 2H2↑+O2 ↑;
2H2↑+O2 ↑; 2Hg+O2↑
2Hg+O2↑ 2H2O+O2↑
2H2O+O2↑ 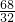 =
=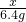 ,解得x=13.6g
,解得x=13.6g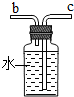 ;
;

 53随堂测系列答案
53随堂测系列答案