
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
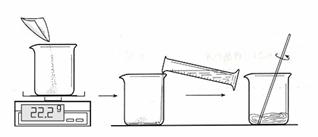 一、配置30℃时的硫酸铜饱和溶液:
一、配置30℃时的硫酸铜饱和溶液:
①配置的步骤如图:
取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由(9) ;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
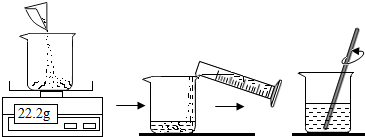
②在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10) ,得到晶体后还要继续加热,直至固体颜色变为(11) 色为止。此操作过 程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
③最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13) g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14)
(写出一条即可);
④测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验 方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
 (2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:
(2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2013-2014学年上海市普陀区中考期末(一模)考试化学试卷(解析版) 题型:探究题
测定溶解度有多种方法,下列是测定30℃时硫酸铜溶解度的实验方法。经查找资料,30℃时硫酸铜的溶解度为25g/100gH2O。
一、配置30℃时的硫酸铜饱和溶液:
(1)配置的步骤如图:

取用100mL水,图中称量得到22.2g硫酸铜用于实验,是否合理,请说出理由 ;并在30℃的水浴中加热硫酸铜溶液一段时间,保证硫酸铜完全溶解,得到饱和溶液。
二、测量一定质量饱和硫酸铜溶液中硫酸铜的质量:
(2)在已配得的30℃时饱和溶液中,迅速取出饱和溶液50g,采用蒸发的方法求得硫酸铜的质量。从饱和溶液中析出蓝色晶体的化学式为(10) ,得到晶体后还要继续加热,直至固体颜色变为(11) 色为止。此操作过程中,用到的仪器除铁架台、酒精灯外,还需(12) 。
(3)最后称量得到固体质量为9.8g,经计算得到此时硫酸铜的溶解度为(13) g/100gH2O(精确到0.1g)。实验反思:实验数值比资料中的数据偏小,可能的原因是(14) (写出一条即可);
(4)测量50g饱和硫酸铜溶液中硫酸铜的质量,还可以使用重量法。
实验原理:CuSO4+BaCl2 →CuCl2+BaSO4↓
该实验方法中一定还要用到的实验操作是(15) (填写操作名称)。若最终得到硫酸钡14.5g,计算溶液中硫酸铜的质量为多少克?(提示:硫酸铜式量为160,硫酸钡式量为233。写出计算过程,精确到0.1g)
查看答案和解析>>
科目:初中化学 来源: 题型:
酸、碱溶液是化学常见的物质,依据所给内容回答问题:
下表是在不同温度下氢氧化钠的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
(1)氢氧化钠溶液中的溶质是 .20℃时,向100克水中加入100克氢氧化钠固体,所得溶液为 溶液(填“饱和”或“不饱和”),其溶液的质量是 克.
(2)在学习过程中,可以判断反应发生的方法有多种.
①向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应.
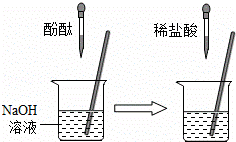
②在如图的实验中,当观察到的现象是 就可证明NaOH与HCl发生了反应.
③不使用指示剂或pH试纸等方法,也可证明反应发生.向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该物质是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com